3.1.1.1 稀溶液的依数性
冬天的一场大雪铺满了整条高速公路,高速公路不得不关闭,但道口处和还处于高速公路中的车辆却动弹不得,车上的人被冻得直发抖。养路工在高速公路上撒下一些白色的药剂。过了一段时间后,天虽然还很冷,但雪没有结冰,反而慢慢融化了,高速公路得以重新开放。养路工撒在公路上的白色药剂就是化学上常见的氯化钙或氯化钠,它与水形成溶液后可使水的凝固点明显下降,饱和氯化钙的凝固点是零下四十多度,怪不得雪很快融化了。
上述案例就用到了稀溶液依数性的知识。不同的溶质溶解在水或其他溶剂中所组成的溶液可以有不同的性质,例如溶液的颜色、体积、导电性、溶解度等的变化取决于溶质的本性;但是所有的溶液都具有一些通性,例如溶液的蒸气压、沸点,凝固点等的变化仅与溶质的粒子(分子或离子)数有关,而与溶质的本性无关,故称为依数性。这种依数性的定性结论是普遍适用的,但严格的定量关系式只适用于难挥发的非电解质稀溶液。稀溶液的依数性在工程技术中有广泛的应用,并体现在以下几个方面:
1.溶剂的蒸气压下降
由于分子运动,液体分子的蒸发和气体分子在液面上的凝聚都存在,在一定温度下达到平衡。平衡时蒸发在气相中的溶剂分子所产生的压力叫饱和蒸气压。若液体中存在其他物质(溶质),溶质分子会占据一部分液体表面,减小了溶剂分子蒸发的速度,而气体分子的凝聚速度没有改变,当达到新的平衡时,气相中的溶剂分子比原纯溶剂有所减少,其蒸气压当然随之下降。其计算公式为:
![]()
式中n(B)表示溶质B的物质的量;n(B)/n表示溶质B的摩尔分数;![]() 表示纯溶剂的蒸气压。这个关系也称为拉乌尔定律。
表示纯溶剂的蒸气压。这个关系也称为拉乌尔定律。
2.溶液沸点升高
恒定温度、压力下,液态物质吸热成为气态物质,我们称之为汽化,在敞口容器中加热液体,汽化先在液体表面发生,随着温度的升高,液体蒸气压将不断增大,当温度增加使液体蒸气压等于外界压力时,汽化不仅在液面上进行,也在液体内部发生(图3-1)。内部液体的汽化产生大量的气泡上升至液面,气泡破裂而逸出液体,我们称此现象为沸腾,液体在沸腾时的温度即为液体的沸点(以符号tb表示)。
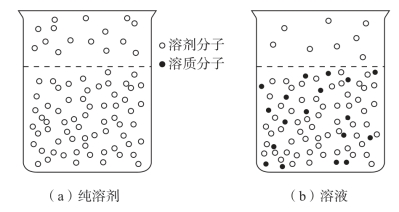
图3-1 纯溶剂与溶液的蒸气压
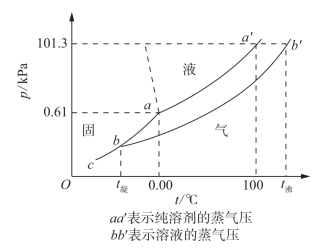
图3-2 水、冰和溶液的蒸气压曲线
如果在水中溶解了难挥发的溶质,其蒸气压就要下降(图3-2)。溶液的蒸气压下降程度取决于溶液的浓度,而溶液的蒸气压下降又是沸点上升的根本原因。水溶液在100℃时蒸气压就低于101.325 kPa,要使溶液的蒸气压与外界压力相等,以使其沸腾,就必须把溶液的温度升高到100℃以上。其计算公式为:
![]()
式中,![]() 叫作溶剂的沸点上升常数,与溶剂性质有关;m为溶液的质量摩尔浓度,mol·kg-1,在稀溶液中与摩尔浓度数据接近。
叫作溶剂的沸点上升常数,与溶剂性质有关;m为溶液的质量摩尔浓度,mol·kg-1,在稀溶液中与摩尔浓度数据接近。
3.凝固点下降
凝固点就是固相与液相共存的温度,也就是固相蒸气压与液相蒸气压相等时的温度,常压下水和冰在0℃时蒸气压相等(610.5 Pa),两相达成平衡,所以水的凝固点是0℃。
水和冰在凝固点(0℃)时蒸气压相等(图3-2),由于水溶液是溶剂水中加入了溶质,它的蒸气压曲线下降,冰的蒸气压曲线没有变化,造成溶液的蒸气压低于冰的蒸气压,在0℃时冰与溶液不能共存,即溶液在0℃时不能结冰,只有在更低的温度下才能使溶液的蒸气压与冰的蒸气压相等。
溶液的蒸气压下降程度取决于溶液的浓度,而溶液的蒸气压下降又是凝固点下降的根本原因。因此,溶液的凝固点下降必然与溶液的浓度有关。19世纪的法国科学家拉乌尔用实验的方法确立了下列关系:溶液的沸点上升与凝固点下降与溶液的质量摩尔浓度成正比,故这个关系也称为拉乌尔定律,可用下式表示:
![]()
式中,![]() 叫作溶剂的凝固点下降常数,它取决于溶剂的特征,而与溶质的本性无关;m为溶液的质量摩尔浓度。
叫作溶剂的凝固点下降常数,它取决于溶剂的特征,而与溶质的本性无关;m为溶液的质量摩尔浓度。
4.渗透压
溶液除了蒸气压下降、沸点上升和凝固点下降三种通性之外,还有一种通性也取决于溶液的浓度,这就是渗透压。
渗透必须通过一种膜来进行,这种膜上的孔只能允许溶剂分子透过,而不能允许溶质分子透过,因此叫作半透膜(如动植物细胞膜、胶棉、醋酸纤维膜等)。若被半透膜隔开的两边溶液的浓度不同,就会发生渗透现象。如图3-3所示用半透膜把溶液和纯溶剂隔开,这时溶剂分子在单位时间内进入溶液内的数目,要比溶液内的溶剂分子在同一时间内进入纯溶剂的数目多,那么会使得溶液的体积逐渐增大,垂直的细玻璃管中的液面逐渐上升。渗透是溶剂通过半透膜进入溶液的单方向扩散过程。
若要使膜内溶液与膜外纯溶剂的液面相平,即要使溶液的液面不上升,必须在溶液液面上增加一定压力。此时单位时间内,溶剂分子从两个相反的方向通过半透膜的数目彼此相等,即达到渗透平衡。这样,溶液液面上所增加的压力就是这个溶液的渗透压力。因此渗透压是为维持被半透膜所隔开的溶液与纯溶剂之间的渗透平衡而需要的额外压力。(https://www.daowen.com)
如图3-4所示,描绘了一种测定渗透压装置的示意图,即在一只坚固(在逐渐加压时不会扩张或破裂)的容器里,溶液与纯水用半透膜隔开,溶剂有通过半透膜流入溶液的倾向。当压力施加于溶液上方的活塞时,为观察到溶液的转移,这时所必须施加的压力就是该溶液的渗透压,可以从与溶液相连接的压力计中读出。
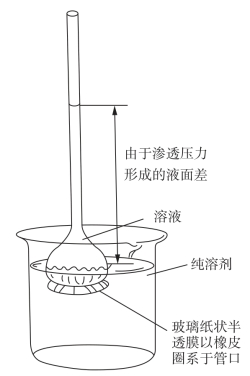
图3-3 显示渗透现象的装置
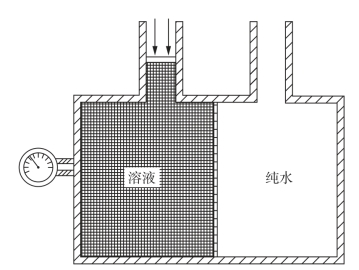
图3-4 测定渗透压装置
当温度一定时,稀溶液的渗透压和溶液的质量摩尔浓度成正比;当浓度不变时,其渗透压与绝对温度成正比(测定装置见图3-4)。若以η表示渗透压,c表示浓度(注意单位是mol·m-3),T表示热力学温度,n表示溶质的物质的量,V表示溶液的体积(单位是m3),则它们之间的关系如下:
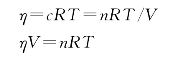
渗透压在生物学中具有重要的意义,有机体的细胞膜大多具有半透膜的性质,因此渗透压是引起水在动植物中运动的主要力量。当我们吃了过咸的食物或在强烈的排汗以后,由于组织中的渗透压升高,就会有口渴的感觉,饮水可减少组织中可溶物的浓度,而使渗透压降低。海水鱼和淡水鱼不能交换生活环境,因为海水鱼体细胞中的细胞液盐的浓度高于淡水鱼体中盐的浓度,若将海水鱼放置在淡水中,则由于渗透作用,水进入鱼细胞壁,以致鱼细胞内液体过多,导致细胞壁胀破,因此海水鱼不能生活在淡水中。反之,若将淡水鱼放置在海水中,鱼体内的水分将向海水渗透,鱼细胞萎缩,所以淡水鱼也不能生活在海水中。
工业上常常利用渗透的对立面——反渗透来为人类服务。所谓反渗透,就是在溶液中施加一个额外的压力,如果这个压力超过了溶液的渗透压,那么溶液中的溶剂分子就会透过半透膜向纯溶剂一方渗透,使溶剂体积增加,这一过程叫作反渗透。
反渗透原理在工业废水处理、海水淡化、浓缩溶液等方面都有广泛应用。用反渗透法来淡化海水所需要的能量仅为蒸馏法的30%,目前已成为一些海岛(如我国的西沙永兴岛)、远洋客轮、某些缺少饮用淡水的国家获得淡水的方法。在国际太空站,工作人员每天饮用的淡水,如用航天飞机或飞船运送上去则成本高昂(每千克折合消耗约2.6万美元),现在通过反渗透装置,可把排泄出的液体重新变为淡水,从而成为真正的“太空水”。利用反渗透法处理无机废水,去除率可高达90%以上,有的竟高达99%。对于含有机物的废水,有机物的去除率也在80%以上。
3.1.1.2 水溶液的酸碱性及表示
1.电解质的解离
人们对酸碱的认识经历了一个由浅入深、由感性到理性的漫长过程。最初,人们对酸碱认识只单纯地限于从物质所表现出的性质上来区分酸碱的,认为具有酸味、能使蓝色石蕊试纸变红的物质是酸;涩味、滑腻感,能使红色石蕊试纸变蓝,并能与酸反应生成盐和水的物质是碱。随着人们对物质本质的认识不断深化,又提出了电解质理论及酸碱理论。电解质是指在溶液或熔融态时能导电的化合物。其导电的原因是该化合物解离成能自由移动的阴、阳离子。这类化合物主要是酸、碱和盐。酸是解离出的阳离子全是H+的电解质,碱是解离出的阴离子全是OH-的电解质。而盐是酸碱中和的产物,可解离出金属离子和酸根离子。
2.水溶液的酸碱性
在生产和生活中,溶液的酸碱性是很重要的性质。溶液的酸碱性主要取决于溶液中H+的浓度。由于水本身也是电解质,能微弱地解离出H+和OH-,故在水溶液中,H+和OH-是共生的,根据化学平衡理论,H+和OH-浓度乘积是一常数![]() ,称为水的离子积常数。在常温下,该常数为10-14。
,称为水的离子积常数。在常温下,该常数为10-14。
![]()
从上式可知,H+和OH-浓度是“此消彼长”的。很多溶液中的H+浓度比较低,用物质的量浓度表示不方便,常用其负对数即pH来表示。
![]()
溶液的酸碱性与pH值的关系为:
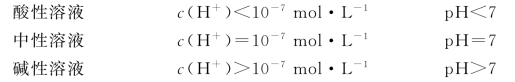
可见,pH越小,溶液的酸性越强;反之,pH越大,溶液的碱性越强。果汁、可乐一般是酸性的,如柠檬汁的pH为2~3;洗涤剂、面碱是碱性的,如肥皂水的pH为10~11。
3.缓冲溶液介绍
在1升中性即pH=7的水溶液中,滴入极少量的酸或碱,如加入0.1 mmol的盐酸(约2滴1 mol·L-1的盐酸),通过计算或测定可知其pH会变为4,明显呈酸性;若滴加的是2滴同样浓度的强碱,pH则变为10,明显呈碱性。少量酸碱的加入可使水溶液的pH发生明显变化。对于某些工业生产或人体生理的实际案例,pH的大幅度变化会造成严重后果。
若溶液的pH不因外加少量的酸、碱而发生明显的变化,则这种溶液就是缓冲溶液。缓冲溶液一般有弱酸-弱酸盐、弱碱-弱碱盐混合溶液组成,也有正盐和它的酸式盐等组成。以弱酸-弱酸盐为例,其机理是溶液中同时存在较高浓度的弱酸和酸根离子,当有少量酸加入时,其酸根离子(称抗酸因子)立即与H+结合,生成难解离的弱电解质,H+浓度几乎未增加,故pH不变;当有少量碱加入时,较高浓度的弱酸(称抗碱因子)立即与少量碱发生中和反应,OH-浓度几乎未增加,故pH不变。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






