1.电池电动势测量原理
电池电动势的测量必须在可逆条件下进行,否则所得电动势就没有热力学价值。所谓可逆条件,一是要求电池本身的电池反应可逆;二是在测量电池电动势时电池几乎没有电流通过。因此,在测量装置上设计了一个方向相反而数值与待测电池的电动势几乎相等的外加电动势,以对消待测电池的电动势。这种测定电动势的方法称为对消法。
电动势的测量原理见图1-10所示,图中Ex为被测电池的电动势,通过电动势的测量装置(如电位差计),输出一个方向相反的外加电动势,使其测量回路中的电流I→0,那么在电动势测量装置上显示的电位值即为被测电池的电动势。当采用电位差计(参阅“电位差计的原理和操作”)测量电池电动势时,不可避免有电流通过电池,但是,如果配用的检流计灵敏度为10-8~10-9A·mm-1,即在测量回路中流过的电流小于10-8A,加上一般电池的内阻都比较大如1000Ω,则在测量时导致的测量误差为ΔEx=10-8×1000V=10-5V或ΔEx=10-9×1000V=10-6V,可以满足测量要求。因此用对消法原理设计的电位差计以及高输入阻抗或高内阻的电压测量仪表,都能较好地满足电动势的测量要求。
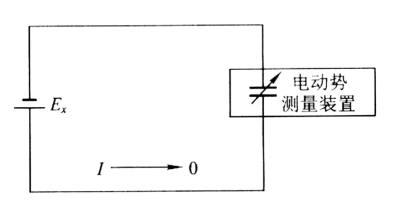
图1-10 电动势测量原理示意图
2.液接界电势
电池中两个电极周围的电解质溶液的性质不同(例如参比电极内的溶液和被研究电极内溶液的组成不一样,或者两种溶液相同而浓度不同等),它们不处于平衡状态。当这两种溶液相接触时,存在一个液体接界面,在接界面的两侧,会有离子往相反方向扩散,随着时间的延长,最后扩散达到相对稳定。这时,在液接面上产生一个微小的电势差,这个电势差称为液接界电势。
例如两种不同浓度的HCl溶液的界面上,H+和Cl-有浓度梯度的突跃。因此,两种离子必从浓的一边向稀的一边扩散。因为H+比Cl-的淌度大得多,所以最初H+以较高的速率进入较稀的一相。这个过程使稀相出现过剩的H+而带正电荷;而浓相有过剩的Cl-而带负电荷,结果产生了界面电势差。由于电势差的存在,该电场使H+的扩散速率减慢,同时加快了Cl-的扩散速率,最后这两种离子的扩散速率相等,此时在界面上得到一个微小的稳态电势,即液接界电势,也称为扩散电势。
液接电势至今无法精确测量和计算,且不可忽视,因此在测量电极电势时,要采取措施减少液接电势。
3.盐桥
减少液接界电势的方法,一般是采用“盐桥”。常见的盐桥有两种,一种是充满盐溶液的玻璃管,管的两端分别与两种溶液相连接,使其导通。其次就是用小烧杯装满盐桥溶液,然后插入两电极。如图1-11所示。
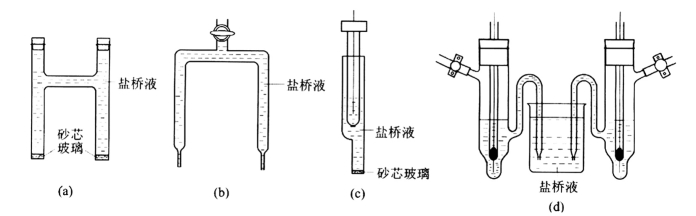
图1-11 盐桥的几种形式
选择盐桥应注意的问题:
(1)盐桥内的正、负离子的摩尔电导率应尽量接近。具有相同离子摩尔电导率的溶液,其接界电势较小,所以在水溶液体系中,通常采用KCl溶液,而且是高浓度(甚至饱和)的溶液。当饱和KCl溶液与另一较稀溶液相接界时,在界面上主要由K+和Cl-向稀溶液扩散,而K+和Cl-的摩尔电导率相接近,因此减小了液接界电势。而且盐桥两端液接界电势符号往往恰好相反,使两端两个液接界电势可以抵消一部分,这样可进一步减小接界电势。
(2)盐桥内溶液必须与两端溶液不发生反应。例如,AgNO3溶液体系就不能采用含有Cl-离子的盐桥溶液,此时可改用NH4NO3溶液作为盐桥。![]() 离子的摩尔电导率分别为73.7S·cm2·mol-1(25℃)、71.42S·cm2·mol-1,两者比较接近,可以有效地减少液接界电势。
离子的摩尔电导率分别为73.7S·cm2·mol-1(25℃)、71.42S·cm2·mol-1,两者比较接近,可以有效地减少液接界电势。
(3)如果盐桥溶液中的离子扩散到被测系统会对测量结果有影响的话,必须采取措施避免。可利用液位差原理使被测溶液和参比电极的液面都比盐桥溶液的液面高,避免盐桥溶液离子流向被测溶液或参比电极溶液中,影响测量结果。
4.参比电极
电极电势的测量是通过被测电极与参比电极组成电池测其电池的电动势,然后根据参比电极的电势求得被测电极的电极电势。水溶液体系中常用的参比电极有氢电极、甘汞电极、银—氯化银电极等,下面介绍甘汞电极、银—氯化银电极、汞—硫酸亚汞电极。
(1)甘汞电极。
甘汞电极是实验室常用的参比电极,它的组成为:Hg|Hg2Cl2|KCl(溶液)(https://www.daowen.com)
其电极反应为:![]()
电极的平衡电势取决于Cl-的活度,通常使用0.1mol·L-1、1.0mol·L-1和饱和式三种。甘汞电极的结构形式有多种,图1-12列出市售的(a)(b)两种和实验室制作的(c)(d)两种。
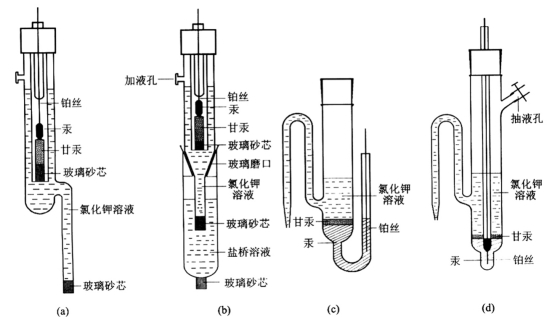
图1-12 不同形式的甘汞电极
实验室常用电解法制备甘汞电极,在电极管底部注入适量的纯汞,再将用导线连接的清洁铂丝插入汞中,在汞的上部吸入指定浓度的KCl溶液,另取一烧杯装入KCl溶液,插上一支铂丝电极作为阴极,被制作的电极作为阳极进行电解,电流密度控制在100mA·cm-2左右。此时汞面上会逐渐形成一层灰白色的Hg2Cl2固体微粒,直至汞面被Hg2Cl2全部覆盖为止。用针筒对电极管压气,将KCl电解液徐徐压出。再吸入指定浓度的KCl溶液。必须注意,抽吸时,速度要慢,不要搅动汞面上的Hg2Cl2层,电极管要垂直放置,避免振动。
甘汞电极的另一种制备方法是将分析纯的甘汞和几滴汞置于玛瑙研钵研磨,再用KCl溶液调成糊状,将这种甘汞糊小心地敷于电极管内的汞面上,然后再注入指定浓度的KCl溶液。采用这种制备工艺时,与汞连接的铂丝应封于电极管的底部。
(2)银—氯化银电极。
银—氯化银电极为:Ag|AgCl|Cl-(溶液)
电极反应为:![]()
其电极电位取决于Cl-的活度。该电极具有良好的稳定性和较高的重现性、无毒、耐震。其缺点是必须浸于溶液中,否则AgCl层会因干燥而剥落。另外,AgCl遇光会分解,所以银—氯化银电极不易保存。
银—氯化银电极主要部分是覆盖有AgCl的银丝,它浸在含Cl-离子的溶液中。该电极的制备可采用制备工艺较好的电镀法:取一段5cm的铂丝作为金属基体,另一端封接在玻璃管中,铂丝洗净后,置于电镀液中作为阴极,用另一铂丝作为阳极。电镀液为10g·L-1的K[Ag(CN)2]溶液。为了保证其中不含过量的KCN,为此,可在电解液中加0.5g AgNO3。电流密度为0.4mA·cm-2左右,电镀时间6h。银镀层为洁白色。将镀好的银电极置于NH3·H2O溶液中lh,用水洗净后,存放在蒸馏水中。最后在0.1mol·L-1HCl溶液中用同样的电流密度阳极氧化约30min。清洗后,浸入含有饱和AgCl和一定浓度的KCl溶液中老化1~2天备用。实验室制备的电极如图1-13所示。
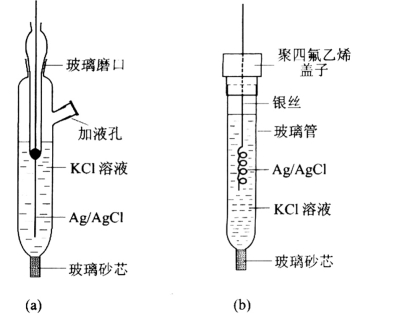
图1-13 银—氯化银电极的形式
也可直接用高纯度的金属银丝(99.99%)制备银—氯化银电极,先用丙酮将银丝除油,如表面有氧化物则可用稀硝酸去除。再用蒸馏水洗净,然后按上述方法阳极氧化即可。
(3)汞—硫酸亚汞电极。
汞—硫酸亚汞电极由汞、硫酸亚汞和含有![]() 离子的溶液组成:
离子的溶液组成:
Hg|Hg2SO4|![]() (溶液)
(溶液)
电极反应为:![]()
其制作方法与甘汞电极相似。在汞的表面上均匀地铺上一层汞和硫酸亚汞的糊状物,电极内的溶液为H2SO4或K2SO4溶液。如果用电解法制备,可采用24%的H2SO4溶液为电解液,电流密度为50mA·cm-2。生成的Hg2SO4呈灰色。保存在大于1mol·L-1H2SO4溶液中,避光,备用。汞—硫酸亚汞电极常用作硫酸体系的参比电极,如铅蓄电池的研究、硫酸介质中的金属腐蚀的研究等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






