无机化学是研究所有化学元素及反应的科学(碳氢化合物及其衍生物除外)。
1.化合价 某元素的一定数目原子跟其他元素的一定数目原子相化合的性质,就是这种元素的化合价,它反映形成化合物时各元素原子之间的个数关系,如氢和氧总是按2∶1的原子个数之比化合而形成水分子的。
化合价有如下规律:
(1)氢元素常为+1价,氧元素常为-2价。
(2)金属元素显正价,非金属元素与氢元素、金属元素化合时显负价,与氧元素化合时显正价。
(3)化合物化合式中,元素的正价总数等于负价总数,单质中元素的化合价为零。一些元素的常见化合价如表8-1所示。
表8-1 一些元素的常见化合价
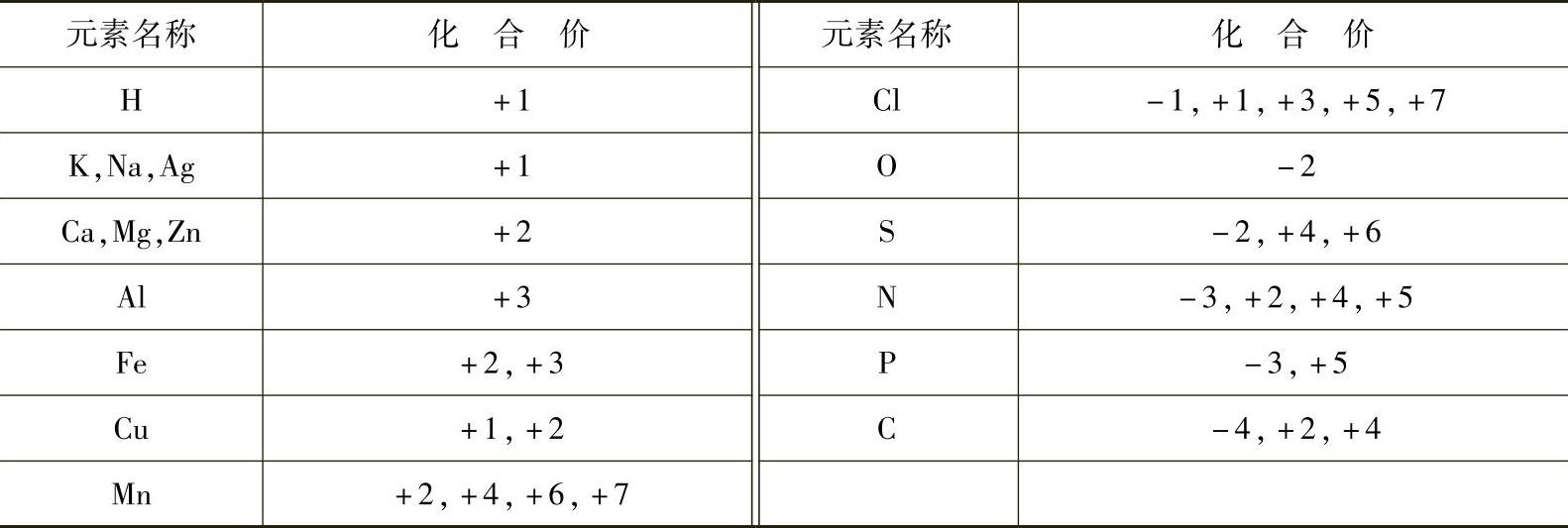
化合价与离子电荷数在标记符号上是有区别的,离子电荷数标在右上角。掌握了元素化合价的规律,可以用于检查书写化学式是否正确(元素的正价总数等于负价总数);从已知化学式中一部分元素的化合价推知另一元素的化合价;根据化学方程式判断该反应是否属于氧化还原反应。
2.化学反应速率与活化能 反应有快有慢,有的瞬间完成,如炸药爆炸、酸碱中和反应;有的反应很慢,如煤和石油的形成需要几万年甚至几十万年。反应速率的大小,首先取决于反应物的本性,此外还与反应物的浓度、温度、催化剂等外界条件有关。反应的必要条件是反应物分子之间的相互碰撞,当分子靠得很近时,分子的价电子云之间存在着强烈的静电排斥力,只有能量足够高的分子,才能在碰撞时以足够的动能去克服它们价电子之间的排斥力,而导致原有化学键的断裂,即两种分子的价电子云互相穿透,形成新的化学键,组成生成物分子。反应速率必须通过实验来确定。
3.元素周期表 元素周期表简称周期表,是元素周期律用表格表达的具体形式。元素周期律的含义是元素的性质,即原子结构、原子半径、元素主要化合价及元素的金属性和非金属性,随其原子序数的递增而呈现出周期性的变化,是原子核外电子排布周期性变化的结果。周期表中具有7个周期,16个族和四个区,一横行称为一个周期,一列称为一个族(性质相似)。在周期表中,元素是以元素的原子序排列的,最小的排列最先。周期表的用途如下:
(1)分析元素的原子结构及元素在周期表中的位置,推断元素的性质。
(2)利用相近元素性质的渐变性,估计元素及其化合物的某些物理性质。
(3)根据已知同族元素形成的化合物的化学式,估计未知同族元素形成的化合物的化学式。
(4)根据元素周期律和已知物质的性质,推断未知物质的性质。
4.化学键 化学键是保持原子结合在一起的吸引力。
物质通常不是以单一原子存在的,而是键合在一起的原子族。原子内部相互作用的方式与在这些原子中电子的数目和排列有关。电子在原子中离原子核距离不同,因而能级也不同,参与键合的电子是那些在原子外层能级上的电子,称为价电子。对周期表中的“A”族元素,原子内可供键合的价电子数目可由其在周期表中的位置确定。“A”族元素的每一个原子具有的价电子数目,都对应于它所在周期表位置的罗马数字族号码,例如族ⅠA的原子有一个价电子,族ⅡA的原子有两个价电子,族ⅦA的原子有7个价电子等。周期表上的“B”族元素,也称为过渡金属,具有不止一组价电子。
原子结合的目标是达到一个更低的能级水平,从而使本身变得稳定。惰性气体是周期表中最稳定的电子,原子结合是为了拥有与其最邻近的惰性气体相同的价电子数目。
5.离子键 离子是带有电荷的原子,保持离子在一起形成结晶的力称为离子键。例如,钠具有11个质子和11个电子,当它失去一个价电子时带正电荷,表示为Na+;一个中性氯原子具有17个质子和17个电子,当它获得一个价电子时带负电荷,表示为Cl-。由于钠离子和氯离子带有相反的电荷,所以相互吸引。
6.共价键 共享的电子组成共价键,由此生成的粒子是分子。在共价键中,两个原子核吸引着相同的电子,这种吸引力将两个原子结合在一起。最简单的共价键分子是氢(H2)。
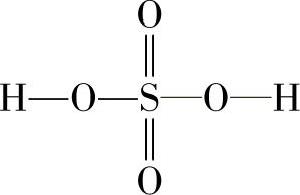
7.分子式和结构式 分子式是化合物的表达式,表示化合物中各种原子的实际数目。化合物的另一种表达形式是结构式,给出分子中每个原子的位置。如硫酸的结构式如下:
8.相对分子质量 使用周期表,把分子中所有的相对原子质量加起来,就能计算出任何化合物的相对分子质量。
9.化学分子式的写法 化学分子式是表示化合物构成的元素符号组合。写一个离子化合物的分子式,只要负离子的电荷与正离子的电荷平衡即可。如写铝和氧的化合物分子式。
铝是ⅢA族元素,是一种金属元素,失去3个电子就成为带3个正电荷的离子Al3+;氧是ⅥA族元素,是非金属元素,获得两个电子生成带2个负电荷的离子O2-。生成化合物的电荷数总和为零,我们找出3和2的最小公倍数6,则形成一个中性化合物,需要2个Al3+和3个O2-离子,即形成的化合物的分子式为Al2O3。注意正离子的符号通常先写。
带正电荷的叫阳离子,带负电荷的叫阴离子。某些离子的电荷不能由周期表中的族数目确定,尤其是过渡元素。
10.化学反应的四种类型
(1)化合反应是两种或两种以上的物质生成另一种新物质的反应,如点燃:
2H2+O2=2H2O
(2)分解反应是一种化合物生成两种或两种以上的新物质的反应如:
H2CO3⇌CO2+H2O
(3)置换反应是一种单质与一种化合物反应生成新的单质和新的化合物的反应如:
2Zn+2HCl=2ZnCl2+H2↑
(4)复分解反应是两种化合物互相交换成分生成新的两种化合物的反应如:
HCl+NaOH=NaCl+H2O
11.沉淀溶解平衡 这在废水处理中是十分重要的内容,详细介绍如下:
(1)溶度积的概念。如将晶态AgCl放入水中,表面上的Ag+及Cl-受到水分子的作用,有部分Ag+及Cl-离开晶体表面而进入溶液,这一过程就是溶解。与此同时,随着溶液中的Ag+及Cl-浓度逐渐增加,它们又受晶体表面的正、负离子吸引,重新返回晶体表面,这就是沉淀。AgCl的沉淀与溶解如图8-1所示。
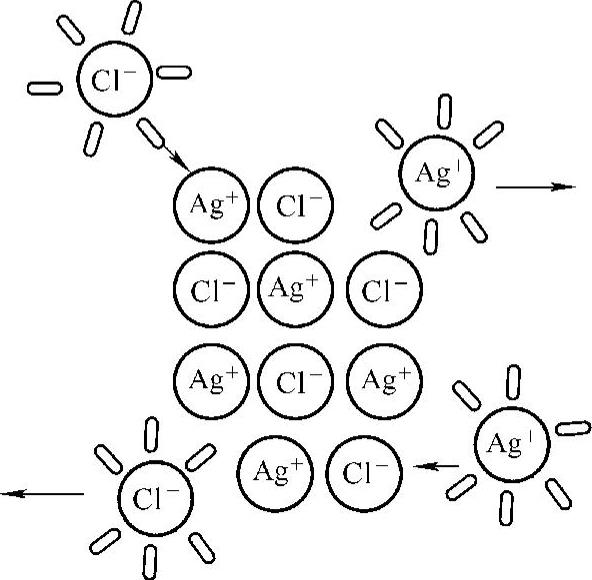
图8-1 AgCl的沉淀与溶解
在一定温度下,当沉淀和溶解速率相等时,就达到了AgCl沉淀溶解平衡,所得溶液即为该温度下AgCl的饱和溶液。AgCl虽然难溶,但溶解的部分却完全电离。平衡的一方(沉淀)为固相,平衡的另一方(离子)在溶液相中,这是一种多相离子平衡:
AgCl(s)=Ag+(aq)+Cl-(aq)
通式 AmBm(S)⇌mAn++nBm-
Ksp(AmBm)=[An+]m[Bm-]n
式中 Ksp——溶度积常数,简称溶度积,反映了物质的溶解能力,表示在难溶电解质的溶液中,各相关离子浓度的乘积在一定温度下是一个常数。
m、n——分别代表沉淀-溶解方程式中A、B的化学计量数。
溶度积仅适用于难溶电解质的饱和溶液,对中等或易溶的电解质不适用。常见难溶电解质的溶度积常数见本书附录。要指出以下两点:
1)温度改变时,溶度积也改变,多数情况下温度升高,溶度积增大。
2)严格地讲,溶度积应当是各离子活度的乘积。但在难溶电解质溶液中,离子浓度都不大,当其他电解质的离子浓度不太大时,可以用浓度代替活度,这样计算就方便了。
(2)溶度积与溶解度的计算。溶解度的定义是:100mL溶剂水中所溶解物质的质量(g)。
例1:已知25℃时AgBr的Ksp=5.0×10-13,求AgBr在水中的溶解度。
AgBr⇌Ag++Br-
解:Ksp=[Ag+][Br-]=5.0×10-13
[Ag+]=[Br-]=7.07×10-7mol/L
AgBr的相对分子量是187.8,则摩尔质量是187.8g/mol。
换算成溶解度的单位:
187.8×7.07×10-7g/L=1.33×10-4g/L
所以25℃时,AgBr的Ksp=5.0×10-13,在水中的溶解度是1.33×10-4g/L。
例2:25℃时,AgCl的溶解度为1.92×10-3g/L,求该温度下的溶度积。
解:首先把溶解度的单位换算成物质的量浓度,再求溶度积。AgCl的相对分子量是143.3,则摩尔质量是143.3g/mol。
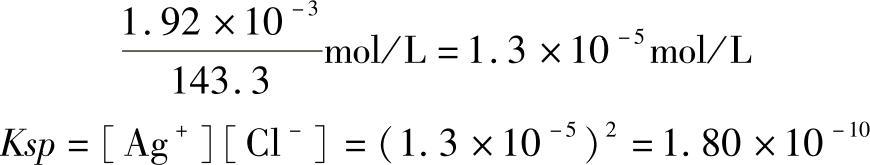
所以25℃时,AgCl的溶解度为1.92×10-3g/L,该温度下的溶度积Ksp=1.80×10-10。
(3)溶度积规则。应用化学平衡移动原理可以判断沉淀-溶解反应进行的方向。以CaCO3为例,在一定温度下,把过量的CaCO3固体放入纯水中,溶解达到平衡时,在CaCO3的饱和溶液中:
[Ca2+]=[CO23-] Ksp(CaCO3)=[Ca2+][CO23-]
1)在上述平衡系统中,如果再加入Ca2+或CO23-,此时:
[Ca2+][CO23-]>Ksp(CaCO3)
沉淀-溶解平衡被破坏,平衡向生成CaCO3的方向移动,故有CaCO3析出,与此同时,溶液中Ca2+或CO23-的浓度不断减少,直至[Ca2+][CO23-]=Ksp(CaCO3)时,沉淀不再析出,在新的条件下重新建立起平衡。注意,此时[Ca2+]≠[CO23-]。(https://www.daowen.com)
2)在上述平衡系统中,设法降低Ca2+或CO23-的浓度,或者两者都降低,使[Ca2+][CO23-]<Ksp(CaCO3),平衡将向溶解方向移动。如在平衡系统中加入HCl,则H+与CO23-结合生成H2CO3,H2CO3立即分解为H2O和CO2,从而大大降低了CO23-的浓度,致使CaCO3逐渐溶解,并重新建立起平衡,此时[Ca2+]≠[CO23-]。
根据上述的沉淀与溶解情况,可以归纳出沉淀的生成和溶解规律。将溶液中阳离子和阴离子的浓度(不管它们的来源)与标准浓度c相比后,代入Ksp表达式,得到的乘积称为离子积,用Q表示。把Q和Ksp相比较,有以下三种情况:
1)Q>Ksp。溶液呈过饱和状态,有沉淀从溶液中析出,直到溶液呈饱和状态。
2)Q<Ksp。溶液呈不饱和状态,无沉淀析出,若系统中原来有沉淀,则沉淀开始溶解,直至溶液饱和。
3)Q=Ksp。溶液呈饱和状态,沉淀和溶解处于动态平衡。
此即溶度积规则,它是判断沉淀生成和溶解的重要依据。
(4)沉淀的生成和分离
1)生成沉淀的条件。根据溶度积规则,在难溶电解质溶液中生成沉淀的条件是离子积大于溶度积。
例:已知BaF2的Ksp=1.84×10-7,现将20.0mL浓度为0.05mol/L BaCl2溶液与30.0mL浓度为0.05mol/L KF溶液混合,有无BaF2沉淀生成?
解:Q=c(Ba2+)c2(F-)2
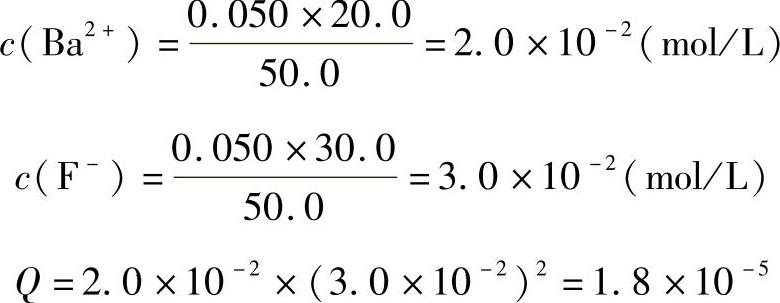
Q>Ksp,有BaF2沉淀生成。
2)沉淀的完全与否。当用沉淀反应分离杂质时,沉淀的完全与否是最关心的问题。严格地说,由于溶液中沉淀-溶解平衡总是存在的,一定温度下Ksp为常数,故溶液中没有哪一种离子的浓度会等于零,即没有一种沉淀反应是绝对完全的。通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达到完全,即该离子被认为已完全除尽。
(5)影响溶解度的因素
1)同离子效应。在已达到沉淀-溶解平衡的系统中,加入含有相同离子的易溶强电解质而使沉淀的溶解度降低的效应,叫做沉淀-溶解平衡中的同离子效应。
例:已知BaSO4的Ksp=1.08×10-10。试比较BaSO4在250mL纯水,以及在250mL[SO24-]=0.01mol/L的溶液中的溶解损失。
解:BaSO4的相对分子量为233.4,则其摩尔质量为233.4mg/mol。
对AB型难溶物,溶解度S=(Ksp)1/2
①设纯水中AB型难溶物的溶解度为S1,则:
S1=(1.08×10-10)1/2mol/L
溶解损失:m1=S1VM
=(1.08×10-10)1/2×250×233.4=0.61mg
②设SO24-溶液中溶解度为S2,则
[Ba2+][SO24-]=S2(S2+0.010)=Ksp=1.08×10-10
因S2不会太大,故S2+0.010≈0.010,则
S2=1.08×10-8mol/L
溶解损失:m2=1.08×10-8×250×233.4=0.00063mg
由上例可进一步推断,欲使某种离子沉淀完全,可让另一种离子(即沉淀剂)过量。这正是实际生产中常用的一种方法。例如,以硝酸银和盐酸为原料生产AgCl时,考虑到硝酸银来自金属银,银为贵重金属,应充分利用,因此常加入适当过量的盐酸,促使Ag+沉淀完全。
从同离子效应的角度看,加入的沉淀剂越多,离子沉淀得越完全。但需指出,过多的沉淀剂反而会使溶解度变大,盐效应就是造成这种现象的原因之一。
2)盐效应。当含有其他易溶强电解质(无共同离子)时,难溶电解质的溶解度比在纯水中的要大,如BaSO4和AgCl在KNO3溶液中的溶解度都大于在纯水中的,而且KNO3的浓度越大,其溶解度越大。这种由于加入易溶强电解质而使难溶电解质溶解度增大的效应称为盐效应。
产生盐效应的原因是由于易溶解强电解质的存在,使溶液中阴、阳离子的浓度大大增加,离子间相互吸引和相互牵制的作用加强,妨碍了离子的自由运动,使离子的有效浓度减小,因而沉淀速率变慢。这就破坏了原来的沉淀-溶解平衡,使平衡向溶解方向移动。当建立起新的平衡时,溶解度必然会有所增加。在沉淀操作中利用同离子效应的同时也存在盐效应,故应注意所加沉淀剂不要过量太多,否则由于盐效应反而会使溶解度增大。在实际工作中,沉淀剂的用量一般以过量20%~50%为宜。
3)酸效应。酸效应就是酸度对难溶化合物溶解度的影响。对于强酸盐,其溶解度受酸度的影响不大;对于弱酸盐,其溶解度随酸度的增大而增大。
4)配位效应。溶液中存在配位剂,与生成沉淀的离子或沉淀形成配位化合物而使沉淀溶解度增大的现象,称为配位效应。
5)影响溶解度的其他因素
①温度。温度升高,溶解度增大。
②溶剂的极性。无机难溶化合物大部分是离子型结构,它们在水中的溶解度要比在有机溶剂中的大,因此在溶解度较大的难溶化合物溶液中加入有机溶剂,它的溶解度就会大大降低。
在实际工作中要根据具体情况来分析哪一种因素是主要的。对于没有配位效应的强酸盐沉淀,应主要考虑同离子效应和盐效应;对于弱酸盐和难溶酸,应主要考虑酸效应;在有配位反应,尤其是能形成较稳定的配合物而沉淀的溶解度又不太小时,应主要考虑配位效应。
(6)分步沉淀。当溶液中含有多种能生成沉淀的离子时,随着沉淀剂的加入,各种沉淀会相继生成,这种现象称为分步沉淀。运用溶度积规则可以判断沉淀生成的次序,以使混合离子分离。
例:向Cl-和I-浓度均为0.010mol/L的溶液中逐滴加入AgNO3溶液,问哪一种离子先沉淀?第二种离子开始沉淀时,溶液中第一种离子的浓度是多少?两者有无分离的可能?
解:假设计算过程中都不考虑加入试剂后溶液体积的变化。根据溶度积规则,首先计算AgCl和AgI开始沉淀时所需的Ag+浓度分别为:
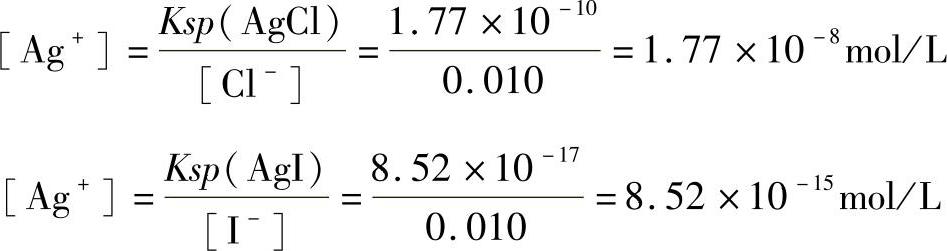
AgI开始沉淀时,需要的Ag+浓度低,故I-首先沉淀出来。当Cl-开始沉淀时,溶液对AgCl来说也已达到饱和,这时Ag+浓度必须同时满足这两个沉淀溶解平衡,所以
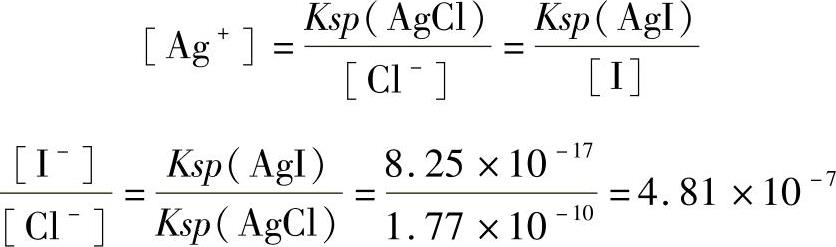
当AgCl开始沉淀时,Cl-的浓度为0.010mol/L,此时溶液中剩余I-的浓度为:
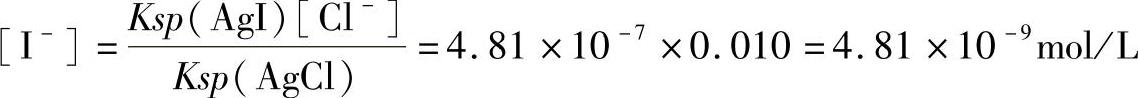
所以当Cl-开始沉淀时,I-的浓度已小于10-5mol/L,故两者可以定性分离。
从上例可以看出:当一种试剂能沉淀溶液中的几种离子时,生成沉淀所需的试剂离子浓度小的首先沉淀。即离子积首先达到其溶度积的难溶物先沉淀,这就是分步沉淀的基本原理。如果各离子沉淀所需试剂离子的浓度相差较大,借助分步沉淀就能达到分离的目的。
废水处理中,利用控制pH值的方法对重金属及氢氧化物进行分离,是分步沉淀的重要应用。
(7)沉淀的溶解和转化。根据溶度积规则,要使沉淀溶解,需降低该难溶电解质饱和溶液中离子的浓度,使离子积小于溶度积,即Q<Ksp,为了达到这个目的,有以下几种途径:
1)转化为弱电解质
①生成弱酸。难溶的弱酸盐,如碳酸盐、醋酸盐、硫化物,由于它们能与强酸作用生成相应的弱酸,降低了平衡系统中弱酸根离子的浓度,致使Q<Ksp。例如,FeS溶于盐酸的反应可表示如下:
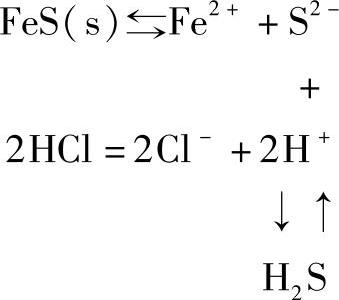
H+与S2-结合生成的H2S为弱酸,又易于挥发,有利于S2-浓度的降低,结果使FeS溶解。CaCO3溶于HCl也是由于生成了易分解的弱酸H2CO3。
②生成弱碱。Mg(OH)2能溶于铵盐是由于会生成难离解的弱碱,降低了OH-的浓度,使平衡向右移动:
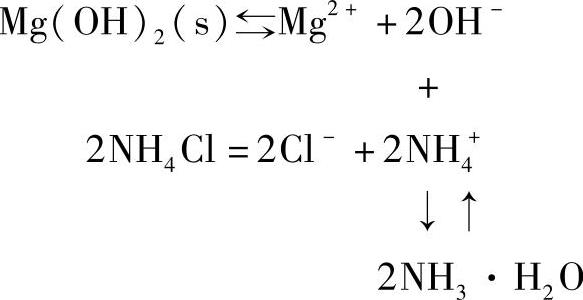
③生成水。一些难溶金属氢氧化物和酸作用,因生成水而溶解。例如,Mg(OH)2溶于盐酸:
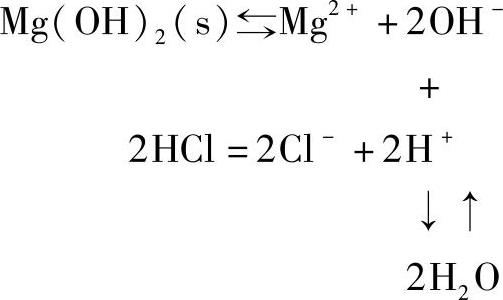
溶解反应的平衡常数与难溶电解质的溶度积及弱电解质的离解常数有关。难溶电解质的溶度积越大,或所生成弱电解质的离解常数越小,越易溶解。
2)发生氧化还原反应。CuS不能溶于盐酸,但能溶于硝酸,是因为HNO3能将S2-氧化成单质S,S2-的浓度降低,使Q<Ksp。
3CuS+8HNO3=3Cu(NO3)2+3S↓+2NO↑+4H2O
3)生成难离解的配电子。当简单离子生成配离子后,由于配离子具有一定的稳定性,使离解出来的简单离子的浓度远低于原来的浓度,从而达到Q<Ksp的目的。如AgBr不溶于水,也不溶于强酸和强碱,却能溶于硫代硫酸钠溶液。这是由于Ag+与S2O23-结合,生成了稳定的配离子[Ag(S2O3)2]3-,从而大大降低了Ag+的浓度,该反应广泛应用于照相技术中。
4)转化为另一种沉淀再溶解。某些难溶盐如BaSO4、CaSO4用上述方法都不能溶解,这时可采用沉淀转化的方法。以CaSO4转化成CaCO3为例,在CaSO4饱和溶液中加入Na2CO3,由于Ksp(CaCO3)小于Ksp(CaSO4),故Ca2+与CO23-能生成CaCO3沉淀,从而使溶液中Ca2+的浓度降低。

这时,溶液对CaSO4来说变为不饱和,故逐渐溶解。只要加入足够量的Na2CO3,提供所需要的CO23-浓度,就能使CaSO4全部转化成CaCO3,而CaCO3是一种弱酸,极易溶于强酸中。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






