§12-4 绝热过程
系统不与外界交换热量的状态变化过程称为绝热过程。实际上,完全的绝热过程是不存在的。但是在有些过程中所传递的热量很少,可以忽略不计;有些过程进行得很迅速,致使系统来不及与外界交换热量。例如,用气筒打气、气体爆炸等。这样的过程都可以近似看做绝热过程。
在绝热过程中,dQ=0,故由热力学第一定律可得
0=dE+dW=dE+pdV
或写成
dW=pdV=-dE
由此可见,在绝热过程中,系统是凭借消耗其内能来对外界做功的。
根据式(12-11)可知,dE=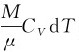 ,代入上式可得
,代入上式可得
上式两边乘CV,再与式(12-15)比较,得
CV(pdV+Vdp)=-RpdV
考虑到R=Cp-CV,γ=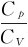 ,整理可得
,整理可得
积分可得
lnp+lnVγ=ln(pVγ)=常量
即有
pVγ=常量(www.daowen.com)
将理想气体状态方程pV=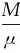 RT代入上式,分别消去p或V,可得
RT代入上式,分别消去p或V,可得
Vγ-1T=常量
pγ-1T-γ=常量
式(12-16a)、式(12-16b)、式(12-16c)统称为理想气体的绝热过程方程,简称绝热方程。三个方程中的常量均不相同,使用时可根据处理问题的方便,任取其中一个应用。
由式(12-15)积分可求得理想气体在有限绝热过程中做的功为
将γ=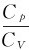 代入上式,可得
代入上式,可得
如图12-7所示的等温线和绝热线,过A点同一气体的等温线分别由绝热过程方程pVγ=常量和等温过程方程pV=常量作出。可以看出,通过同一点的绝热线(实线)比等温线(虚线)陡些。下面对两条线交点A处斜率通过计算加以讨论。对绝热过程和等温过程方程取微分可得
γpVγ-1dV+Vγdp=0 pdV+Vdp=0
由此可得,在p-V图中绝热线和等温线的斜率为
由于γ>1,故绝热线斜率的绝对值大于等温线斜率的绝对值,即绝热线比等温线更陡些。这是因为在等温膨胀时,压强的降低ΔpT仅由气体密度减小而引起,而绝热膨胀时,除气体密度减小外,气体的温度也要降低。所以ΔpS>ΔpT。
例12-1 氮气液化,把氮气放在一个有活塞的绝热壁包围的汽缸中。开始时,氮气的压强有50倍标准大气压,温度为300K。经急剧膨胀后,其压强降至1倍标准大气压,从而使氮气液化。试问此时氮气的温度是多少?(1标准大气压=1.013×105Pa)
解 把氮气视为理想气体,其液化过程可当做绝热过程。由题意知p1=50×1.013×105Pa,T1=300K,p2=1×1.013×105Pa,由表14-1可查得氮气的γ=1.40。所以按绝热方程式(12-16c)可得
将已知数据代入上式,有
T2=300×0.020.286=98.0K
这个值只是大略的估计值。因为在低温时氮气不能再视为理想气体,而且把氮气的膨胀过程视为绝热过程也只是近似的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

 RT两边取
RT两边取




