§12-3 气体的摩尔热容
一、热容量和摩尔热容量
若系统在某一无限小过程中吸收热量为dQ,系统相应的温度变化为dT,定义
为系统在该过程中的热容量。式(12-10)表示在该过程中,温度升高1K时系统所吸收的热量,单位为J/K。单位质量的热容量叫比热容,单位为J/(K·kg),通常用小写字母c表示。热容量和比热容的关系为
C=Mc
1摩尔物质的热容量称为摩尔热容量,用字母Cμ表示,单位为J/(mol·K)。热容量与摩尔热容量的关系为
式中,M为物质的质量;μ为物质的摩尔质量;比值M/μ为对应的物质的量。由定义知热容量、摩尔热容量、比热容都是过程量。对于给定的热力学系统,进行的过程不同,其热容量也不同。
二、理想气体的摩尔热容量
理想气体在不同的状态变化过程中,其热容量的量值不同。故气体热容量的量值都是针对一定过程的,最常用的是等体过程的摩尔热容量和等压过程的摩尔热容量。固体和液体也有这两种热容量,但是由于它们的体膨胀系数比气体小得多,因膨胀对外做功可以不计,所以这两种热容量实际差值很小,一般不予区别。所以下面的讨论是针对理想气体而言的。
1.定体摩尔热容量
理想气体在等体过程中的摩尔热容量称为定体摩尔热容量,用CV表示。按照式(12-10)定义其量值为
由上式可知,质量为M的气体在等体过程中,温度改变dT时所需的热量为
将上式代入式(12-7),即得
对于有限的等体过程,可写出
应强调指出,不能误会因为式(12-11)和式(12-12)中含有CV,就以为两式只能在等体过程中才能应用。理想气体的内能只与温度有关,因此理想气体在不同的状态变化过程中,只要温度增量相同,则不论气体经历什么过程,它的内能增量都是一样的,都可用式(12-11)和式(12-12)进行计算。由于在等体过程中,系统内能的增量与吸收的热量相等,两式中才会出现CV。(https://www.daowen.com)
2.定压摩尔热容量
理想气体在等压过程中的摩尔热容量称为定压摩尔热容量,用Cp表示。按照定义其量值为
由前面对等压过程的讨论可知
dQp=dE+pdV
由式(12-11)以及理想气体状态方程可知,在等压过程中,p=恒量,故有
代入上式则有
再由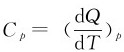 可得
可得
Cp=CV+R
上式表明,当1mol理想气体的温度升高1K时,它在等压过程中要比其在等体过程中多吸收8.31J的热量,以用于对外做功。
定压摩尔热容量Cp与定体摩尔热容量CV的比值称为摩尔热容比,用γ表示,即
由于Cp>CV,所以γ恒大于1。
表12-1为部分气体摩尔热容量的实验值和理论值。从表中可以看到,对于单原子分子气体和双原子分子气体,其理论值和实验值很相似,而对于多原子分子气体,其理论值与实验值就存在较大差异。其原因一方面是忽略了在多原子分子中不可略去的振动能量;而更根本的原因在于所依据的经典热容理论的缺陷,只有用量子理论才能圆满地说明气体摩尔热容量的各种问题。
表12-1 几种气体摩尔热容的理论值和实验值
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








