人们一直猜测PPO在光合作用中的潜在角色(Mayer and Harel,1979;Vaughn and Duke,1984)。虽然在理论上是可能的,但是缺乏证据来支持或者推翻这个猜测。植物PPO经常被发现紧密结合于类囊体膜上,几乎所有的PPO都包含转运肽,靶向于质体的类囊体膜的内部管腔。番茄、玉米和豌豆PPO的体内和体外实验实现了该转运肽向叶绿体的转运及其蛋白的水解。类囊体腔的蛋白质运输到类囊体腔会发生典型的两步切割机制。PPO已被发现是由核编码,但仍处于非活动状态,直到并入质体,表明其在光合作用中可能发挥作用。支持PPO参与光合作用的论点包括:(1)PPO的活化与叶绿体中不断提高的O2浓度的关联(Vaughn and Duke,1984);(2)PPO蛋白质与光合系统的联系(Lax and Vaughn,1991;Sheptovitsky and Brudvig,1996);(3)酚类化合物会抑制循环和/或非循环光合磷酸作用(Neumann and Drechsler,1967),言外之意就是PPO可以通过氧化这些潜在底物来减少这种抑制;(4)在植物生长发育过程中可以独立地增加或者降低底物水平和儿茶酚酶的活性(Winters and Minchin et al.,2008);(5)通过环境因素,如极端的温度、干旱和一年中时间的变换来调节PPO的活性(Sofo and Dichio et al.,2005;Lee and Kim et al.,2007)。
现在已经有几种解释PPO可以直接影响光合作用的机制,包括PPO可以作为氧缓冲 剂(Mayer and Harel,1979;Vaughn and Duke,1984),或者与Mehler-过氧化物酶或水循环相互作用(Tolbert,1973)来促进活性氧的清除,如图3-2所示。与光系统I(PSI)中捕光色素同时被纯化表明可能参与Mehler反应(Tolbert,1973)。也有研究显示,多酚氧化酶与光系统II(PSII)有关,涉及在叶绿体的某些代谢过程(Lax and Vaughn,1991),可能有氧的调节功能。PPO催化多酚类化合物的氧化反应,生成邻醌和水,这一过程是需氧的,因此PPO可调节氧气的量使之处于适宜的状态(Steffens and Harel et al.,1994),同时,光合作用与PPO联系紧密,可以提供足够的还原力来还原邻醌形成邻苯二酚(Vaughn and Duke,1984)。这个假设的局限性在于,叶绿体中缺乏PPO的明确的反应底物;另外,PPO催化反应的速率赶不上光合作用的速率。PPO能够与Mehler-过氧化物酶循环发生相互作用,这是因为醌类物质也可以作为氢的受体,PPO使还原态醌发生再氧化,降低了其含量。通过这种方式,一种假循环式的电子传递可以在没有净氧变化的情况下发生(Tolbert,1973),而这也是水循环发生的方式(Asada,1999)。然而,目前缺乏明确的证据去支持这个假设,而水循环和ROS的清除过程则已经是非常清楚的过程(Asada,1999;Apel and Hirt,2004)。与上述假设不同的是,在番茄实验中,突变株(PPO被抑制表达)在加强光抑制方面,比野生株的表现更好(Thipyapong and Hunt et al.,2004)。
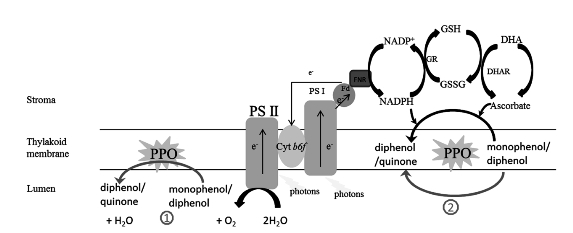
图3-2 PPO与光合作用的潜在相互作用机制
The potential interaction of PPO with photosynthesis(i)by acting as an oxygen buffer in the lumen to prevent O2-formation,and(ii)to buffer NADPH accumulation in the stroma to prevent over-reduction of the photosystems.SH(GSSG),reduced(oxidized)glutathione;DHA,dehydroascorbate;GR,glutathione reductase;DHAR,dehydroascorbate reductase(Boeckx and Winters et al.,2015).(https://www.daowen.com)
当NAD(P)H/NAD(P)积累到较高水平时,则可抑制光合作用的电子传输,这对降低过度还原具有潜在作用(Foyer et al.,2012)。邻羟基酚-抗坏血酸的还原/氧化循环与抗坏血酸-谷胱甘肽循环相连,这个过程涉及NAD(P)H的氧化,可以在CO2固定作用降低的情况下来防止过度还原。有强光的条件下,腔内O2浓度水平提高,较低pH条件下潜伏态PPO被激活,可以催化上述反应。然而这种情况会减少对电子传输循环的需求,醌会与抗坏血酸发生反应,但与其他腔内反应相比较,抗坏血酸盐可以参与该反应的程度是不清楚的(Tóth and Schansker et al.,2013)。
另一种解释认为,当O2浓度低时,PPO的作用对类囊体腔内的暗反应比光反应更重要(Sheptovitsky and Brudvig,1996)。因为在光照下,环境处于酸性状态,而PPO酶的最适pH是8,使得在这种环境中PPO不能表现出活性状态(Sheptovitsky and Brudvig,1996)。然而,这一理论不太可信,因为许多相关研究发现PPO的最适pH在4~8之间(Yoruk and Marshall,2003)。Leufken等学者(2015)的研究工作解释了这种多变的研究现象,他们证实PPO羧基端构象改变时,会使PPO的最适pH改变(Leufken and Moerschbacher et al.,2015)。而且,潜伏态PPO可以在低pH条件下激活(Winters and Minchin et al.,2003;Schmitz and Sullivan et al.,2007),这种低pH环境是由叶绿体接受光照后降低腔内pH而实现的。同时,叶绿体PPO发挥活性需要还原力;在光照下叶绿体中可以观察到对香豆酸氧化成咖啡酸的反应,这一反应在没有添加抗坏血酸盐或NADPH的黑暗条件下是不能发生的(Halliwell,1975)。这些观察研究证实了PPO在光照条件下发挥活性作用与抗坏血酸和/或NAD(P)H有关。
在许多情况下,PPO直接调节光合作用可能并不现实,因为光合作用还有许多各自的支路(Vinyard and Ananyev et al.,2013)。PPO间接影响光合作用的观点似乎更有说服力。因为PPO的单酚酶活性理论上可以催化对香豆酸转化为咖啡酸(Vaughn and Duke,1984),这是酚类物质生物合成中苯基丙酸类合成路径的起始步骤。近来发表的研究成果表明,PPO基因沉默表达的胡桃木叶子的代谢谱发生了变化,尤其是涉及色氨酸和酪氨酸的代谢通路(Araji and Grammer et al.,2014)。然而有争议的是,在PPO沉默的植株中观察到内源性酪胺的增长和多巴的减少,因为正常情况下PPO可以催化酪氨酸氧化成多巴,催化酪胺氧化为多巴胺。目前,这些胡桃没有其他酶具备这些化学反应的特征。对野生型植株叶子应用内源性酪胺,可以观察到植株坏死的表型,这在PPO沉默植株中也能够观察到相同的现象,这支撑了PPO在胡桃酪氨酸代谢中具有的基本作用。在大花金鸡菊中表达的PPO产物可以参与橙酮的形成(Kaintz and Molitor et al.,2014),这进一步支持了PPO在次级代谢中具有潜在作用。一些相关报道论证了酚类物质的抗氧化能力(Pietta,2000),表明其可以作为自由基清除剂(Agati and Matteini et al.,2007),甚至可以作为光化学能量消除剂,比如羟基肉桂酸的酚酸亚类(特别是绿原酸)(Grace and Logan,2000)和类黄酮的花青素亚类(Neill and Gould,2003)。因此,通过调节多酚物质,PPO可以间接影响光合细胞的光防护能力,并独立于Mehler-过氧化物酶循环等过程。然而,有时苯丙烷代谢的上调并不是总伴随着PPO活性的降低(Rivero and Ruiz et al.,2001;Sofo and Dichio et al.,2005;Lee and Kim et al.,2007)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






