PPO的调控规律是复杂的,这种酶可以同时以活性或者潜伏态(没有活性,常是一种前体形式)状态存在于同一原材料中。这种潜伏的程度并不是普遍存在的,在不同物种和不同组织中也不相同。例如,在红苜蓿(Trifolium pratense)的根部组织中存在活性和潜伏态形式的PPO,但是白色苜蓿(Trifolium repens)只有潜伏态;相反,在地上部分,红苜蓿和白苜蓿都含有活性和潜伏态(Webb and Cookson et al.,2013)。在高等植物中,PPO被认为是与膜结合的。在类囊体膜中以潜伏态形式存在的酶不参与液泡中酚类化合物的合成,但有机体发生衰老、损伤或逆境胁迫时该酶被激活。在一些植物组织中,PPO与膜的紧密连接限制了它的活性,用非离子型表面活性剂处理,可以使酶从膜上脱离,并表现活性(Gandía-Herrero and Jiménez-Atiénzar et al.,2005)。然而,酶的潜伏期可能并不仅仅受限于完整的细胞膜,在其他植物中,酶脱离质膜后仍旧存在潜伏期,并需激活。
潜伏态酶的潜伏程度随植物种类和组织的变化存在很大差异。在体外试验中,对激活潜伏酶的研究已有数年,并发展了各种处理方法或试剂以激发酶活。采用霜冻、老化、脂肪酸、醇、变性剂、表面活性剂、酸碱处理、蛋白酶处理、超声和温和的热处理可以诱导潜伏态酶的激活。PPO结合抑制剂的去除也可能导致潜伏态酶的活化,另外,潜伏酶可以通过多种形式互变现象被激活。蘑菇潜伏型酪氨酸酶可被SDS、苯甲醇和丝氨酸蛋白酶激活,该过程的特征是在平衡状态前会出现一个迟滞期,这表明通过细微构象改变即可实现酶的激活(Seo and Sharma et al.,2003)。
在有机体内,潜伏酶的激活可以看作酶和底物直接作用的结果。有学者观察非蛋白水解活化类型的PPO的羧基端决定了PPO的最适pH值,并认为非蛋白水解活化可以在植物中发生(Leufken and Moerschbacher et al.,2015)。在内源性邻苯二酚存在时,红苜蓿的潜伏态PPO有被激活的可能性。邻苯二酚介导的活化是一种间接激活机制,产生的邻苯醌类产物与潜伏态PPO相互作用,使得它们的结构发生变化,暴露出活性位点(Winters and Minchin et al.,2008)。这个机制可能发生在组织损伤时,例如被取食或者衰老相关的细胞死亡等。据观察,在菠菜(Spinacia oleracea)叶片衰老的过程中,酚酶活性的增加伴随着潜伏态PPO的减少。最近,有学者鉴别出一个假定的PPO酶(从大花金鸡菊中提取的橙酮合酶)的醌结合位点,他们认为这个位点与潜伏态PPO的变构激活有关(Boeckx and Winters et al.,2015)。
蚕豆、葡萄和甘薯中的PPO是通过羧基端蛋白酶解使得潜伏PPO转化为活性结构(Flurkey and Inlow,2008)。部分酶解PPO蛋白可以激活潜伏PPO这一观点常有不同的解释。潜伏态的菠菜PPO可以同时被天然和变性胰蛋白酶激活,也就是说具有催化活性的胰蛋白酶并非激活过程中的主要元素,这使胰蛋白酶激活机制的性质尚不明确(Tolbert,1973)。膜结合的活性菠菜PPO可能有一定的蛋白酶功能,然而有关酶分裂机制的性质目前少有研究(Sheptovitsky and Brudvig,1996)。相关研究显示,小麦种子内PPO的活化源自非特异性蛋白质-蛋白质相互作用,并非胰蛋白酶的蛋白水解作用(Saluja and Sachar,1982)。一般认为,内源性蛋白酶通过裂解PPO的某特定区域激活潜伏态PPO,如蛋白质水解的消化作用。因此,常在分离纯化过程中加入蛋白酶抑制剂以避免潜伏态PPO的激活。
为解释蛋白水解激活的机制,前人也曾作过研究。蚕豆在蛋白酶抑制剂的存在下,用SDS处理激活,仅能观察到分子质量为60 kD的潜伏态PPO(Robinson and Dry,1992)。另外,在体外试验中,蛋白酶切该60 kD的酶可产生一个42 kD的活性PPO和一个15~18 kD的非活性肽,据此推测,蛋白酶对潜伏态酶的部分酶解使酶蛋白羧基末端蛋白酶敏感位点缺失,并由此激活了潜伏态酶(Robinson and Dry,1992)。目前尚不清楚生物体内是否发生了此类蛋白酶裂解。然而,在体内,叶绿体内PPO的羧基末端的加工是激活潜伏态酶的先决条件,如激活60 kD前体产生一个40 kD活性葡萄PPO,但在体外试验,蛋白酶解并不能产生40 kD的PPO,这个40 kD的PPO并不是分离纯化过程中人为形成的。当转运肽从氨基末端脱落,蛋白质羧基末端延伸区去除,此时叶绿体内形成了一个包含双铜结合区的更小的PPO形式。这40 kD PPO的含量和酶活性之间存在正相关。因此,幼小不成熟的浆果存在60 kD PPO,但其PPO活性微乎其微,这进一步证明了生命体内发生前体加工是激活潜伏态酶的必要条件(Rathjen and Robinson,1992)。
阴离子去垢剂如SDS,是激活潜伏态PPO时广泛使用的催化剂。事实上,加入SDS后蛋白质的三级和四级结构发生了剧烈改变,大部分酶会因此失活,PPO内二硫键的存在可能协助PPO对抗SDS。用SDS诱导不同植物的PPO,它们的活化程度存在很大差异,例如,在特定的实验条件下,蚕豆PPO活性增加65~119倍(Jiménez and García-Carmona,1996),葡萄增加19倍(Sánchez-Ferrer and Bru et al.,1989),桃 增加25倍(Laveda and Núñez-Delicado et al.,2000),香蕉增加10倍(Sojo and Nuñez-Delicado et al.,1998),马铃薯叶增加4倍(Sanchez-Ferrer and Laveda et al.,1993),芒果增加7倍(Robinson and Loveys et al.,1993)。SDS对PPO活性的催化程度依赖许多参数,大量文献主要围绕SDS浓度和pH值开展研究。
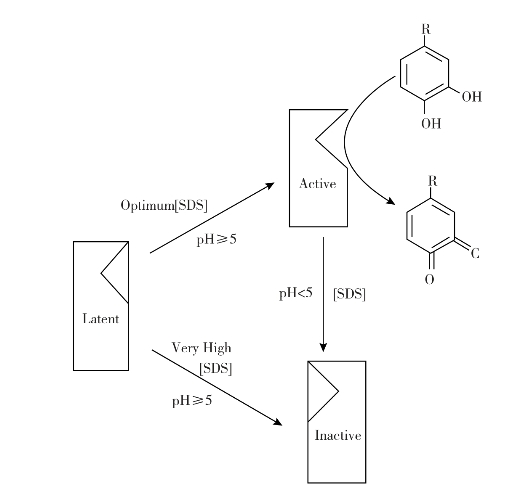
适宜的SDS浓度和pH≥5的条件能有效活化酪氨酸酶,而相同pH值下过高浓度的SDS会造成蛋白变性;体系内有SDS但pH≤5时活性酶会变成非活性酶,如图2-4所示。不考虑动力学特点,利用蛋白酶处理酪氨酸酶异构体也出现相似的反应机制。蘑菇潜伏型酪氨酸酶对含有托拉氏毒素的激活作用十分敏感,该毒素是托拉假单胞菌褐斑病中产生的某种真菌酯酰肽。另一种激活剂,3-羟基-2-氨基苯甲酸(HAA)能够模仿真正的底物二元酚,充当伪底物影响酶活性。看似互不相关的底物所引起的酶活化往往是酶分子构象改变、酶溶解与移除抑制剂的作用结果(Seo and Sharma et al.,2003)。
 (https://www.daowen.com)
(https://www.daowen.com)
图2-4 pH值与SDS对潜伏态蘑菇酪氨酸酶的激活作用(Espín and Wichers,1999)
低浓度SDS即可激活PPO,而较高浓度会显著抑制酶的活性。综合研究蚕豆提取物中的潜伏态PPO表明,随着SDS浓度的增加,潜伏态酶的激活程度呈S形曲线,在某些情况下,当SDS浓度高于去垢剂的临界胶束浓度时,PPO活性受抑制。SDS对马铃薯叶片PPO激活程度取决于试验底物,最佳催化条件是pH为4的疏水底物(Sanchez-Ferrer and Laveda et al.,1993)。但也有学者认为任一试验底物对蚕豆PPO的催化并无显著差异(Jiménez and García-Carmona,1999)。
通过试验研究pH值和SDS对PPO激活的共同效应,发现SDS导致酶最适pH升高。但这种情况似乎并不普遍,对于某些PPO而言,是否加入SDS并不会影响其最适pH。对于蚕豆提取物,加入SDS最适pH由4.0变为5.0(Jiménez and García-Carmona,1996)。未添加SDS时,在酸性pH条件下可以测得的PPO活性主要是由于酸胁迫造成的。总体而言,加入SDS后酶最适pH均高于4.0,在pH低于4.0时,并未观测到酶的激活或者完全抑制现象。这是由于酶内存在的一个特异SDS结合中心对pH变化极为敏感,因此,pH为4.0高于实际上成为SDS激活效应的限定条件。在高pH值下,SDS对水果PPO的激活并不是改变酶自身的潜伏性,而是外源SDS和pH的共同作用。
Moore和Flurkey对SDS激活潜伏蚕豆PPO进行了详细的研究,并提供了新的观点用以解释该激活机制。加入SDS后,PPO结合少量的SDS并引起有限的构象变化,SDS和该构象变化共同改变酶的物理特性及酶学性质,这种激活模型同早期学者的研究结果一致。另外的证据来自对蘑菇PPO动力学研究,前人发现蘑菇PPO在潜伏状态已有大于95%的酶活力,通过SDS诱导缓慢的构象变化即可激活(Van Leeuwen and Wichers,1999)。从这些研究中发现PPO的一个蛋白域控制催化中心入口,该域结构受pH和SDS共同作用发生移位或被蛋白酶水解剪切(Marques and Fleuriet et al.,1995;Jiménez and García-Carmona,1996)。
相关研究发现SDS激活型和蛋白酶激活型的PPO对pH有不同的要求(Jiménez and García-Carmona,1996)。上文提到pH低于4.0时很少或几乎无法检测到由SDS激活的PPO活性,而在酸性pH时,蛋白酶的激活作用非常活跃,这表明潜伏态酶在不同pH环境下的活动取决于激活酶时所借助的调节剂。环糊精通过与SDS形成非共价复合体,从而可以使SDS介导的活化过程完全可逆(Laveda and Núñez-Delicado et al.,2000)。通过改变pH、脂肪酸、醇和去垢剂的激活作用也是导致酶构象变化的结果。
在完整的活组织内,潜伏态PPO与活跃态PPO之间的比例仍然是有争议的,因为目前还不清楚PPO酶的天然形式是否可以在人工的分离纯化过程中得以保存。温和型的温度诱导相分配法被认为可分离纯化得到天然潜伏状态的PPO。然而,尚未明确体内发生的激活是否为正常反应。一般来说,老化、缔合-解离现象或相关组织中内源性化合物,如脂肪酸、蛋白酶、萜烯、苯甲醇或低分子量抑制剂的解离作用都可能生理性地活化潜伏态PPO。另外,有学者认为对于完整的组织而言,叶绿体中氧浓度和pH值的改变会调控PPO的活性。酶的潜伏程度目前并不明确,酶的潜伏程度可能因植物来源、发育阶段和活化剂类型产生差异。在病原体的攻击下潜伏态PPO也可以被激活,这暗示潜伏态酶的激活可能参与免疫应答机制。
除了植物以外,在微生物、动物、昆虫体内,酪氨酸酶也以潜伏型和激活型两种形式存在(Whitaker and Lee,1995)。如双孢蘑菇菌柄内潜伏型酪氨酸酶占总酶活性的98%~99%(Van Leeuwen and Wichers,1999)。体外实验中真菌酪氨酸酶可以通过酸应激、十二烷基硫酸钠和蛋白酶激活,体内酶的活化是暴露于极端环境和病原菌以及成熟老化的结果(Halaouli and Asther et al.,2006)。酶活化机制尚未完全阐明,目前推断为酶促的构象改变或蛋白溶解。一般认为,真菌体内酶的活化涉及内源性的蛋白酶,比如在双孢蘑菇收获后衰老过程中提取得到的丝氨酸蛋白酶,这样的蛋白酶也可见于米曲霉内。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







