相比其他含铜的酚氧化酶(如漆酶),真菌酪氨酸酶是具有丰富异质性的胞内酶。最初的研究表明,酪氨酸酶具有多样的分子质量(Van Gelder and Flurkey et al.,1997)。早期利用天然菌柄提取物纯化双孢蘑菇酪氨酸酶的试验表明该酶具有多种形式,且多为聚合态。1963年,Bouchilloux等学者利用电泳和羟磷灰石层析法验证了多种表观分子量为118~119 kD的酪氨酸酶形式(α、β、γ和δ),这些形式可能是30~34 kD单体聚集的结果(Bouchilloux and McMahill et al.,1963)。1969年,Jolley等学者分离出5种不同形式(I,Ia,II-IV)的酪氨酸酶,变化程度从单体到八聚体,同时他提出酪氨酸酶的主要形式是由同一32 kD单体组成的四聚体(Jolley and Robb et al.,1969)。Strothkamp等学者推测前人分离所得α、β、γ和δ形式的酪氨酸酶事实上是包含不同43 kD重链(H)和13~14 kD轻链(L)的多肽杂聚物。在水溶液中,表观分子量为69 kD的L2H似乎是酶的活化型,同时Strothkamp还指出,30~34 kD单体是轻链L二聚化的产物(Strothkamp and Jolley et al.,1976)。后来,相关研究人员鉴定出两种重链——Hα(48 kDa)和Hβ(45 kDa),并以此推测出α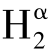 L2和γ
L2和γ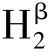 L2两种同工酶(Lerch,1981)。综上,酪氨酸酶呈现的多种形式可以归功于构象异构、基因表达差异和限制性蛋白水解(Halaouli and Asther et al.,2006)。
L2两种同工酶(Lerch,1981)。综上,酪氨酸酶呈现的多种形式可以归功于构象异构、基因表达差异和限制性蛋白水解(Halaouli and Asther et al.,2006)。
蘑菇提取物中高分子量的酪氨酸酶形式被认为是粗提物中纯化过程人为造成的。通常情况下,除去特异性含有酪氨酸酶的菌株,真菌体内的酪氨酸酶会因为富含酚类及色素物质而使蛋白表现出较高的表观分子量(Jolivet and Arpin et al.,1998)。另外有试验表明利用阴离子交换层析或特定吸附剂除去双孢蘑菇酪氨酸酶纯化过程的酚类物质会导致几种酶亚型的消失。Flurkey利用等电点(pI)差异分离出两组双孢蘑菇酪氨酸酶,一组等电点在4~4.5,另一组在4.5~5,后来Gerritsen等学者研究发现较低等电点的酪氨酸酶发生糖基化(Gerritsen and Chapelon et al.,1994),而较高等电点的并没有(Flurkey,1991)。从双孢蘑菇菌株U1的子实体内分离出两种单体的酪氨酸酶,它们分别由基因AbPPO1和AbPPO2编码,等电点分别约为5.2和5.1,还原状态下分子量均为43 kD,原始状态为47 kD,这两种单体酶都有活性(Wichers and Recourt et al.,2003)。AbPPO1和AbPPO2的cDNA其开放式阅读框(ORF)显示它所编码的酪氨酸酶分子量约64 kDa,但双孢蘑菇提取物中该酶经丝氨酸蛋白酶活化后的分子量约为45 kD,对该菌中酶的切割推测表明处于381位置的酪氨酸(胰凝乳蛋白酶切割位点)羧基端为指定切割点(Wichers and Recourt et al.,2003)。起初人们认为粗糙脉胞菌酪氨酸酶是由活跃的47 kDa单体形成的四聚体(Robb and Gutteridge,1981),但现在学者认为它是75 kD前体发生蛋白水解后形成的42 kDa全酶活性单体,这种由407个氨基酸组成的成熟酶是在前酪氨酸酶苯丙氨酸(类胰凝乳蛋白酶切割位点)羧基端切掉213个氨基酸(21 kD)后形成的(Kupper and Niedermann et al.,1989)。米曲霉酪氨酸酶是由67 kDa亚基形成的四聚蛋白,该酶在酸应激下被激活,各亚基均为活跃态(Fujita and Uraga et al.,1995)。从香菇菌子实体的菌褶中可以分离出6种酪氨酸酶异构体,且均由一个催化亚基(54或55 kD)和一个假定的调节亚基(15或50 kD)组成(Kanda and Sato et al.,1996)。以白腐真菌为胞内媒介在血红密孔菌中分离得到全新的45 kD单体酶,利用等电点聚焦发现该酶有4种异构体形式,这些异构体的出现可能是磷酸化程度的差异和结合酚类后球面电荷的差异所致(Halaouli and Asther et al.,2005)。(www.daowen.com)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






