基于酪氨酸酶和儿茶酚氧化酶活性由同一个结构催化的事实(Mayer,2006),双铜原子有同样的催化潜能,因此推测其他因素调节这一反应;有些物种的PPO具有双活性,但是有些仅能催化邻苯酚氧化。PPO在物种间的巨大差异并未得到深入探讨,借助铜原子可有效解释酶家族巨大差异的机制。
PPO单酚和二酚氧化作用的总体机制如图2-1所示,因整合了双活性过程,它为结构上的反应过程和结构状态的转变提供了清晰观点。基于铜活性位点的几何结构和电子结构,可以推导该酶的催化作用机理,其结构类似于行使氧转运功能的血蓝蛋白(Gerdemann and Eicken et al.,2002)。
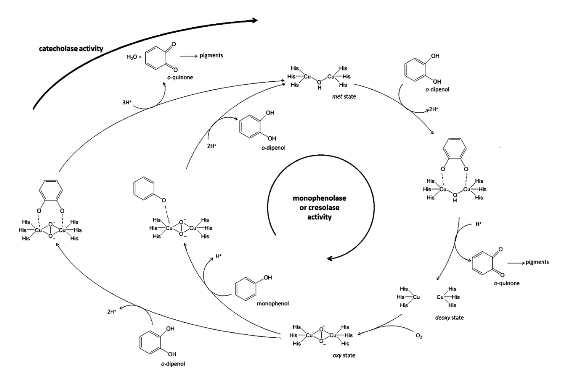
图2-1 PPO对一元酚和二元酚的氧化途径
Schematic illustration of the mechanism of PPO including the structures of the o-diphenol and monophenol substrates for the catecholase and monophenolase reactions(Boeckx and Winters et al.,2015).
酶活性位点由两个铜原子与三个保守的组氨酸残基配体组成,催化过程中,酶活性位点结构发生改变(Klabunde et al.,1998),这与其电子性质的改变有关,在酪氨酸酶活性催化循环中,两个耦合的铜以三种形态存在(met,deoxy,oxy),即met-PPO(Cu+2)、脱氧-PPO(Cu+1)和氧化-PPO(Cu+2)。该酶的静止形式被认为是met-PPO。它通过将单分子儿茶酚氧化为邻苯醌,从而还原为脱氧PPO。单酚氧化途径中酶活性部位结合氧气分子形成含氧PPO中间体。单酚类底物只能与含氧PPO反应形成PPO-氧-单酚三元复合物(Lerch,1995)。当单酚形成邻苯醌后,产物与PPO脱离。PPO转化为脱氧PPO,且不需循环经过静止形式即可参与新一轮循环。在二酚氧化途径中,双酚底物的反应可以与含氧PPO和met-PPO发生反应。Met-PPO氧化一分子的邻苯二酚,并还原为脱氧PPO,之后结合氧气,形成含氧PPO形式,并形成邻苯二酚-PPO复合物。在儿茶酚氧化为邻苯醌后,酶还原到met-PPO形式(Lerch,1995)。
动力学结果表明,在有序的序列机制中,酶首先结合氧再结合单酚。虽然随机序列机制可以解释邻苯二酚和氧与酶(脱氧PPO)结合的过程,但考虑到化学循环步骤中近端途径机制时,这似乎依然是有序的过程。在有序的Bi Bi机制中,一般情况也假定氧气是二酚酶活性中第一个被PPO结合的底物,然而,复合物中各产物的去除顺序尚未阐明(Gerdemann and Eicken et al.,2002)。
Wilcox等人(1985)比较了不同的单酚和双酚底物的氧化过程的反应动力学常数,表明在单酚中,体积较大的取代基会显著降低羟基化反应速率,而二元酚的取代基大小对其氧化速率影响不大。这说明在铜催化位点周围的蛋白口袋处,单酚经历了从轴向到赤道向的排列,各苯环取代基之间可能存在空间位阻(Wilcox et al.,1985),而PPO催化二酚氧化为邻苯醌却少有几何结构和电子等要求。后来,为研究苯环不同取代基对PPO催化反应速率的影响,以苹果、梨(Espin et al.,1998b)和蘑菇(Espin et al.,2000)为对象进行了定量研究(核磁共振分析及动力学数据分析),实验结果表明,如果取代基具有高电子供体能力,那么单酚羟基的氧原子对双核铜中心的亲核效应就会明显加强,因此,具有高的电子供体取代基的单酚氧化更迅速。然而,侧链取代基的大小(位阻效应)对催化速率影响并不显著,这是由于单酚的亲核能力低;对邻苯二酚而言,取代基的电子供体能力被证明对氧化速率的影响不大,但取代基的大小(位阻效应)变得非常重要(Espín and Varón et al.,2000)。(https://www.daowen.com)
综合考虑动力学因素,以及基于粗糙脉孢菌(Neurospora crassa)PPO反应途径中三种状态下酶的形式(met-PPO,deoxy-PPO和oxy-PPO),整理得到一个不同植物来源PPO中单酚酶和二酚酶活性反应机制的模型(见图2-2)(Fenoll and Rodri'guez-López et al.,2001)。该反应机制可以解释不同果蔬中单酚酶和双酚酶的活性作用。这一模型额外引入了化学氧化还原的循环过程,在酶催化的作用下,邻苯二酚产生两个邻苯醌。
如图2-2所示,单酚氧化路径从PPO所具有的单酚酶活性开始。在这一作用过程中可以观察到典型的滞后期,可以理解为形成足够数量的邻苯二酚使met-PPO转变成oxy-PPO是需要一定时间的。在单酚氧化路径中,met-PPO-单酚是一个末端复合体,因此结合单酚的met-PPO不表现酶活性,滞后期随着单酚浓度升高而延长,从而需要更多的时间达到平衡。与此同时,醌化学循环产生的邻苯二酚驱动末端复合体即met-PPO-单酚进入催化循环过程,可以产生必要的邻苯二酚水平以维持平衡状态。然而,随着酶浓度的增加滞后期缩短,反应体系产生更多的oxy-PPO,邻苯二酚剂量增加会消除滞后期,加速了平衡状态的到来(Rodriguez-Lopez and Tudela et al.,1992)。
尽管尚未完全清楚上述反应机制是否适用于所有PPO,但铜对PPO活性的必要性都是统一且显而易见的。利用铜螯合剂从酶中除去铜将会导致酶活性相对降低,且该酶活性可以通过加入过量的铜复原(Yoruk and Marshall,2003)。从植物、动物、真菌和细菌PPO的氨基酸序列信息可知,它们都具有两个保守的铜离子结合位点——CuA和CuB(Gooding and Bird et al.,2001)。这种双核铜是酶与底物发生相互作用的位点。此外,序列对比研究显示存在于节肢动物和软体动物中的血蓝蛋白与一些PPO在铜结合配体处具有较高的同源性(Klabunde and Eicken et al.,1998);通过X射线晶体衍射分析得到的血蓝蛋白结构可以作为研究PPO的切入点,预测出PPO活性位点的结构模型。
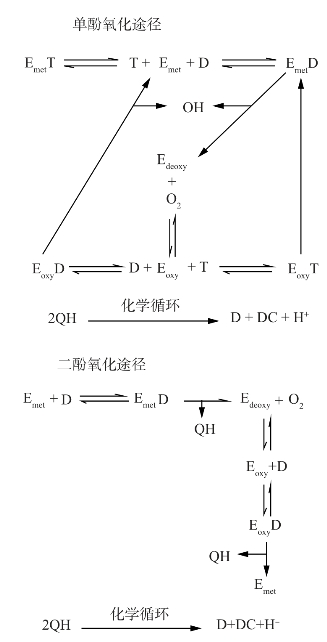
图2-2 PPO对单酚和邻苯二酚耦合邻醌非酶促反应的反应机理
Emet,met-PPO;Edeoxy,deoxy-PPO;Eoxy,oxy-PPO;T,单酚;QH,oquinone-H+;D.o-diphenol;DC,aminechrome.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






