1.5.2.1 漆酶的活性中心
真菌漆酶经常以同工酶的形式出现,通过寡聚以形成多聚体。单体的分子量为50~100kD。真菌漆酶包含一个以共价连接的碳水化合物部分(占10%~45%),这可能有助于保证这些酶的高稳定性,也是真菌漆酶的一个重要特征。Coprinus cinerius真菌中的漆酶的晶体结构现已获得(Ducros and Brzozowski et al.,1998;Ducros and Brzozowski et al.,2001)。枯草杆菌孢壁蛋白cotA已被鉴定为漆酶(Hullo and Moszer et al.,2001),且晶体结构亦被提出(Enguita and Matias et al.,2002)。
漆酶完成其催化功能,至少需要4个铜原子:
类型1:顺磁“蓝”铜,吸光度在610nm(ox.)。
类型2:顺磁“非蓝”铜。
类型3:抗磁自旋耦合铜-铜,吸光度在330nm(ox.)。
植物漆酶是一种有22%~45%糖基化的胞外蛋白酶(Solomon and Sundaram et al.,1996),而多酚氧化酶是胞内蛋白酶,其糖基化程度还不明确(Steffens and Harel et al.,1994)。它们都是多铜氧化酶,但是多酚氧化酶具有一个双核3型铜中心,漆酶是一个有四个铜离子的三核簇(Solomon and Sundaram et al.,1996)。
利用4个铜原子在3个位点的分布情况,并结合它们的光谱特性,可以确定酶将还原性底物中4个单电子的氧化与氧气中4个电子的还原裂解相偶联。漆酶典型的金属含量包括一个type-1(T1)铜(Cu1)、一个type-2(T2)铜(Cu2)和两个type-3(T3)铜(Cu3),其中Cu2和Cu3排列于一个三核中心(TNC),如图1-10所示。
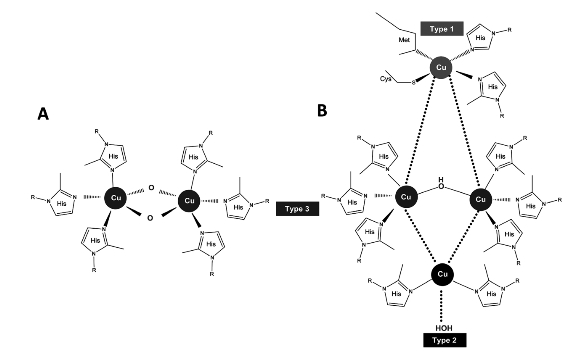
图1-10 酪氨酸酶/儿茶酚酶(A)和漆酶(B)的活性中心(Boeckx and Winters et al.,2015)。A和B均包含一个双核的3型铜中心,B还包含单核的1型和2型铜中心。
迄今已报道了众多担子菌门漆酶的三维结构,如灰盖鬼伞漆酶Lác-Cc(CcL1A65)(Ducros and Brzozowski et al.,1998)、变色栓菌漆酶LccI(TvL1GYC)和LacIIIb(TvL1KYA)(Bertrand and Jolivalt et al.,2002)、木硬孔菌漆酶RlL(R1G1V10)(Garavaglia and Teresa Cambria et al.,2004)、硬毛栓菌漆酶TtL(TtL2HRG)(Matera and Gullotto et al.,2008)的晶体结构均已被阐明。另外,子囊菌门中,目前仅报道了来自Melanocarpus albomyces的漆酶三维结构,包括了天然酶MaL(MaL1GWO)以及表达于里氏木霉的重组酶rMaL(rMaL2Q9O)(Giardina and Faraco et al.,2010)。细菌漆酶的三维结构也得到了阐明(Roberts and Weichsel et al.,2002)。这些漆酶均展示出相似的分子结构,三个结构域一组,排列形成类似铜氧还蛋白的结构。其中每个结构域都含有希腊钥匙β-折叠桶拓扑结构,该拓扑结构与小型铜蛋白如天青蛋白和质体蓝素严格相关,并被如抗坏血酸氧化酶和哺乳动物血浆铜蓝蛋白等MCOs成员所共有。Cu1位于结构域3,而三核中心(TNC)嵌入在结构域1和结构域2之间,且这两个结构域共同为铜提供配位残基。担子菌门漆酶通过结构域1、3和结构域1、2之间的两个二硫键稳定结构,而子囊菌门漆酶MaL1GWO中却发现了3个二硫键(Hakulinen and Kiiskinen et al.,2002)。
超过100种漆酶的多重序列的比对结果显示,鉴定的4个无缺口序列区域,L1~L4,是漆酶的总体标志性特征,可以将其与其他类别的多铜氧化酶区别开来(Kumar and Phale et al.,2003)。作为铜配位体的12个氨基酸残基,处于这些保守区域L1~L4之内。L2和L4遵循之前报道的多铜氧化酶,而L1和L3则为漆酶所特有。三核簇的氨基酸的配体是8个组氨酸,位于在4个高度保守的HXH模块中。X是与T1铜结合半胱氨酸,而每个组氨酸与3型铜的双铜之一结合。值得注意的是,将L1~L4序列域映射到漆酶三维结构上时,呈现出一个特殊的、或多或少C-2对称的蛋白质构象模体,该模体是具有酶活性部位特征的装置,如图1-11所示。当测定L2和L3与L2和L4的内在蛋白同源性时可以发现,在结构与序列水平上,这种类似C-2对称的活性部位构象模体都似乎是结构性复制的产物。
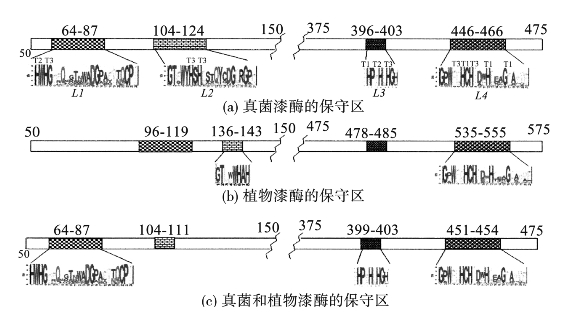
图1-11 漆酶的多重序列比对
Overview of the multiple sequence alignment for laccases.Eighty percent consensus sequence obtained after multiple sequence alignment of(a)64 fungal laccase sequences;(b)40 plant laccase sequences;(c)consensus sequence from(a)and(b).Multiple sequence alignment of protein sequences was carried out using ClustalW(Thompson et al.,1994).The conserved regions are shaded if the length of the sub-sequence is greater than 7 residues.The corresponding regions,which are conserved both in plant and fungal laccases,are shaded in the same pattern.The starting residue number for a given region is shown with reference to C.cinerius laccase in(a)and(c)and with reference P.taeda laccase in(b),while the length of the sub-sequences is shown in parenthesis immediately below.Sequence logos(Schneider et al.,1990)are shown for selected regions,L1-L4,which represent the frequency of occurrence of each amino acid at a particular position in the ungapped region of the aligned protein sequences.Height of a letter in the logo represents the information content at that location(Kumar and Phale et al.,2003).
1.5.2.2 T1铜及该铜与还原性底物的反应
在典型的MCOs中,Cu1通常与轴向第四个配体,通常是蛋氨酸,四面体地配位结合,形成第一个配位层。漆酶Cu1则与一个半胱氨酸的硫原子和两个组氨酸的Nδ1氮原子呈现出平面三角形的配位结合。从半胱氨酸S原子→Cu2+的电荷位移跃迁是614 nm光波下出现强烈光吸收谱带的原因,其摩尔吸收系数ε为5300 L/mol·cm,酶呈现出深蓝色。Cu1是漆酶催化反应中的原电子受体位点,即还原性底物发生4个单电子氧化的位点。电子通过高度保守的组氨酸-半胱氨酸-组氨酸三肽转移到TNC,并在那里将氧气还原为水,如图1-12所示(Marcus and Sutin,1985)。
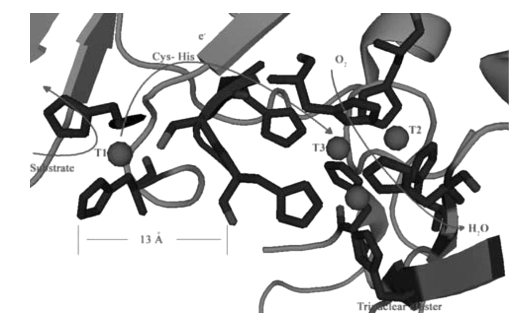
图1-12 漆酶活性中心,箭头表示底物,电子和氧气的走向(Solomon and Augustine et al.,2008)
Cu1的还原是催化过程的限速步骤,并涉及马库斯“外配位界”机理(Marcus and Sutin,1985)。在这一机理中,Cu1的E0与还原性底物E0之间的电位差ΔE0决定了电子转移速率(Xu and Shin et al.,1996)。通过对大量不同漆酶的电位滴定确立了Cu1的E0值,参比一般氢电极(NHE)时可见实质变异在420~790 mV。缺少第四个配位基是漆酶比其他MCOs成员具有更高E0值的重要决定因子,这在长绒毛栓菌漆酶(Xu and Palmer et al.,1999)和近期细菌漆酶(Durao and Bento et al.,2006)的诱变试验中均有印证。不同的漆酶是如何在相似的Cu1配合物结构下调整它们的氧化还原电位是一个仍待全面阐述的重要问题。
Cu1占据酶表面的一个低洼地带,这可能使得该区域成了原电子受体位点。Cu1凹陷结构相当宽,它能够调整与多类别底物的结合,但并未紧紧包埋底物。通过有机还原性底物,2,5-二甲代苯胺,与凹陷的结合情况,TvL1KYA首次展示了高分辨率的漆酶结构(Bertrand and Jolivalt et al.,2002)。上述凹陷结构中,4个环区的残基参与了许多疏水性蛋白配体间的相互作用,如图1-13所示。此外,His458和Asp206在还原性底物的氨基与漆酶的结合过程中起重要作用;与Cu1配位并在所有MCOs中高度保守的His458环离2,5-二甲代苯胺的N原子很接近,二者形成的氢键距离仅为3.2Å,这表明His458位点是电子转移至Cu1的入口。
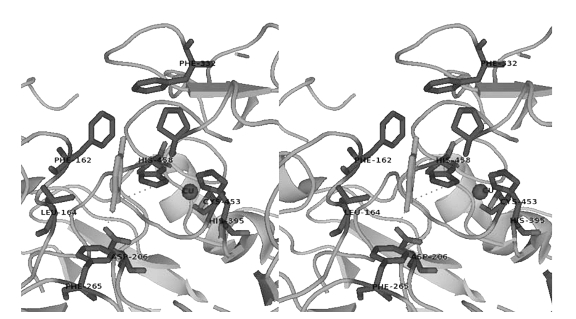
图1-13 TvL1KYA的活性中心的立体结构,与2,5-二甲基苯胺底物结合(Giardina and Faraco et al.,2010)(https://www.daowen.com)
2,5-二甲代苯胺的氨基还可以同Asp206侧链的末端氧形成氢键,该氧原子位于结合位点的背面。Asp206在担子菌门漆酶中相对保守,而在子囊菌门中会形成谷氨酸盐。Asp206与还原性底物的相互作用还能调节漆酶活性对pH的依赖(Xu and Berka et al.,1998):当pH从3升到5,以酚类为底物时测得KM值减小,这是Asp206侧链去质子化的结果。在pH 5条件下,Asp206(pKa3.9)(Bertrand and Jolivalt et al.,2002)羧基解离,给予活性部位负电荷,促进酶与携带功能性-OH或-NH2的底物之间的相互作用。最近从TvL1KYA突变体得到的数据巧妙地支持了Asp206在酶与酚类底物反应中的作用(Madzak and Mimmi et al.,2006)。
Xu等人提出假设,以2,6-二甲氧基苯酚(DMP)为漆酶反应底物时,Cu1和还原性底物之间的氧化还原电位差引起酶活性—pH曲线图走势的上升,此时酶更偏好高pH环境。DMP的pKa接近9.9,在酸性环境下并不能自发去质子化,活性中心邻近的羧基残基与还原性底物的相互作用协助DMS去质子化(Xu,1997)。
Piontek等人对Cu1的配位距离和E0之间的相互关系提出假设:配位距离越长,初始电位越高(Piontek and Antorini et al.,2002)。TvL1GYC中延长的Cu-N键距能够影响氧化还原电位,减少从氮到铜原子的自由电子对转移,铜愈加电子不足,这将引起高位氧化态的不稳定性,提高铜的氧化还原电位。Cu-N键距的增加是Ser113和Glu460之间氢键形成的结果,Glu460与His458位于同一螺旋内,氢键使该残基远离了Cu1,如图1-14所示。Garavaglia等学者通过观察高E0漆酶R1G1V10确证了Piontek等学者所提出的假设(Garavaglia and Cambria et al.,2004)。这种漆酶中的Glu459和Ser113残基通过一个很强的氢键发生连接,该氢键与TvL1GYC中的氢键发挥同一作用。R1G1V10中His-Cu的配位距离最长,达2.20Å。序列数据表明在所有高E0漆酶中,TvL1GYC中Phe460位点和Ser113位点高度保守,甚至在某些解木质素真菌内,尽管E0未知,这两个位点仍然高度保守。
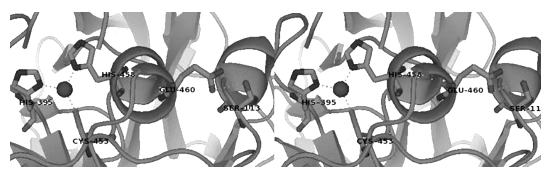
图1-14 TvL1GYC的Cu1位点,Ser113和Glu460的氢键使α-螺旋远离(Giardina and Faraco et al.,2010)
据漆酶TtL2HRG的结构,Matera等人提出,Cu1近周两个疏水残基,Phe460和Ile452,利于形成所观察到的高氧化还原电位。而且,当Phe460额外地被大量疏水性残基所包围时,Cu1氧化还原电位升高(Matera and Gullotto et al.,2008)。
上述结构分析表明,漆酶间Cu1氧化还原电位的差异可归因于某一结构特性,但需众多因素共同作用,如Cu1的配位结构、影响溶剂可及性的二级球形残基的特性、氢键以及Cu1位点周围的介电各向异性。
此外,Tadesse等人还证实底物的氧化还原性和底物分子的空间位阻将大幅影响酶的氧化能力(Tadesse and D’Annibale et al.,2008)。长绒毛栓菌漆酶和嗜热毁丝霉漆酶的氧化还原电位明显不同(分别为0.76和0.46 V),两个苯丙氨酸残基(TvL1KYA中Phe332和Phe265)标志着活性位点入口,其距离反映酶对兼性氧还电位底物的氧化能力(见图1-13)。
1.5.2.3 T2/3铜簇及它们与氧气的反应
Cu2/Cu3铜簇中有3个铜原子,呈三角分布,在MCOs中始终与高度保守的4个His-X-His模体配位结合。6个组氨酸残基配位结合Cu3铜对,余下2个组氨酸残基则配位结合Cu2。Cu2具有一个特别的电子顺磁共振(EPR)波谱,与Cu1的波谱明显不同,而Cu3铜对是反磁性耦合离子,EPR沉默。光学上,Cu3吸收330 nm的光(吸光系数ε约3600L/mol·cm),Cu2却几乎不可测定(Torres and Svistunenko et al.,2002)。三核中心TNC发生与氧气的结合,当4个电子从单核中心Cu1转移到TNV中两个分别配位于Cu3a和Cu3b的组氨酸时,氧气发生还原并减少。氧气还原位点上发生的三铜原子催化情况至今仍是热烈争论的问题。
Solomon课题组完成了对MCOs中铜/氧分子中间体主要的动力学和光谱特征的研究分析(Yoon and Liboiron et al.,2007)。关于漆树R.Vernicifera,已有相当数量的光谱学和动力学研究报告,近来,酿酒酵母的类漆酶蛋白Fet3p也受到了同样的关注(Augustine and Kragh et al.,2008)。基于对MCOs中氧气中间体的光谱学研究,确立了氧气还原为水的分子机制。处于完全还原态的酶吸收一个氧气分子,通过2步连续的双电子反应,分别形成了过氧中间体(PI)和自然中间体(NI),其中第一步是速率控制步骤,而第二步涉及2e-的O-O键还原裂解,反应速率更快。
在完全还原态下,TNC处于不饱和配位状态。铜簇附近负电荷的出现似乎平衡了它的高正电荷,调谐了铜簇的不饱和配位状态与氧化还原性质,共同致力于铜簇与O2的反应活性。尤其是Cu2附近出现的高度保守的阴离子残基(对应于TvL1KYA中D77)对还原态TNC和O2的反应至关重要。
自然中间体NI是完全氧化的种类,其中O2已完全还原变为水平状态的产物,通过μ3-氧基和μ2-羟基桥接配位体束缚于TNC上。因为μ3-氧基桥能够使三铜中心发生电子离域,易引起铜簇电子转移,使得N1的桥接结构与N1快速发生的得4e-还原反应相协调从而生成完全还原态酶。比较起来,静息态是完全氧化态N1的另一种模式,只是Cu2与铜簇中其他原子相离。当缺乏还原性底物时,N1会以一定速率退化为静息态,但由于该退化速率太低以至不参与催化循环过程,因此,通常将N1视为酶的催化性完全氧化型。实际上,通过连续性质子辅助发生的N1退化过程涉及μ3-氧基配体的结构重排,即从铜簇内位移到铜簇外,然后形成静息型酶。在这种酶型下,O2的一个氧原子以OH—键连接于铜簇外的Cu2上,Cu3的2个铜原子也通过一个OH—桥接(Giardina and Faraco et al.,2010)。
TNC中3铜中心经由Cu1被还原性底物循序地还原。Yoon等人对N1还原反应过程提出了合理的机制(Yoon and Liboiron et al.,2007)。根据他们的理论,Cu3a首先发生还原,因为靠近Cu2和Cu3b中心带负电荷残基(即TvL1KYA中D77)的还原电位显著低于Cu3a中心的还原电位;随后,Cu2似乎比Cu3b更早还原;最后,Cu3b通过Cu1和Cu3中心的His-Cys通道发生快速还原,同时从TNC分离出2分子水。另外,假如Cu3b先于Cu2发生还原反应,那么OH—桥接发生质子化,电子迅速转移到Cu2,Cu2和Cu3b的电子耦合将会消失。
利用X-射线对细菌漆酶CotA和MCOs进行结构分析,Bento等人对氧气的还原反应机制提出了不同见解(Bento and Martins et al.,2005)。主要不同在于静息型亦作为催化循环中间体发挥作用。目前所知的和利用同步加速辐射所获得的MCOs结构数据很难准确地解释配位结构、键长以及Cu1氧化位点,Cu2/Cu3的活性部位亦是如此。高强度X-射线同步加速辐射下,晶体的暴露使金属蛋白发生渐进还原。那么在数据采集过程中,铜中心还原,酶启动氧化还原循环;而晶体又暴露于空气中,氧气发生还原反应形成水,反复数次的催化性循环所产生的电子密度图可以反映催化步骤的平均数。如此,在有氧和高pH环境下,这种适于MCOs的新策略被投入诱捕中间体,且有学者观察到了铜原子的渐进还原。在漆酶LtL2QT6的氧气还原反应中,分别测定了由氧气得2e—和4e—产生的连续性中间体PI和NI的结构。相异于光谱学研究所提供的结构,PI中的过氧键似乎只与Cu3的铜对发生连接,而不与Cu2发生连接;PI通过某次级步骤被进一步还原,同时氧化Cu2和远处的Cu1形成NI。此时的NI呈现出与光谱学研究一致的典型结构,即具有TNC中3个铜原子的氧桥接结构(μ3-氧基配体)和Cu3铜对中的羟基桥接结构。
漆酶R1G1V10、LtL2QT6和TtL2HRG的晶体结构中,Cu3a和Cu3b与羟基/水分子不对称配位。在漆酶R1G1V10的结构中,假设Cu2和Cu3b原子的氧化态更低可以解释Cu3铜对与羟基的不对称配位(Cu3a-OH键短于Cu3b-OH键)。这种不对称结构对分子氧的断裂推进十分重要。漆酶LtL2QT6和TtL2HRG结构中,Cu3a比Cu3b更靠近Cu1位点。根据Kyritsis等人对抗坏血酸氧化酶的理论推算,则Cu1-Cu3a的还原效率是Cu1-Cu3b还原效率的3倍,可见这种不对称配位导致TNC还原反应的差异(Kyritsis and Messerschmidt et al.,1993)。
位于蛋白质结构内部的两个溶剂通道为进入TNC提供了入口。第一个通道从TNC的某一面指向Cu3铜原子对,允许分子氧的进入与结合;第二个通道从铜簇的另一面指向Cu2原子,将氧气还原形成的水迁移至溶剂中。
1.5.2.4 羧基端尾域的作用
通过推导来自子囊菌门中柄孢霉、粗糙脉孢菌、M.albomyces和M.thermophila的漆酶氨基酸序列可以发现一个外延的羧基端尾域(包含13~14个氨基酸)。这段尾域通常在某个保守位点发生蛋白质水解,断裂形成酶的活化型。通过分析真菌M.albomyces漆酶的三维结构,发现该尾域外延成栓会堵塞溶剂通道,暗示在分子氧的进入和后续水分子的退出过程中,尾域的断裂可能是必需的(Giardina and Faraco et al.,2010)。
Kiiskinen和Saloheimo对酿酒酵母漆酶MaL1GWO的表达进行了研究,他们指出酵母装置无法正确地加工羧基末端,而在羧基末端自然加工位点后出现的终止密码子增强了漆酶活性(Kiiskinen and Saloheimo,2004)。此外,Bulter等人研究发现,当定向改造漆酶序列,引入Kex2蛋白酶位点后,在酿酒酵母中来自M.thermophila的漆酶可以正确地完成羧基末端的加工。由此可见,羧基末端的加工对子囊菌门漆酶的激活至关重要(Bulter and Alcalde et al.,2003)。
Zumarraga等人对羧基端尾域进行了两种连续的突变处理并筛选出M.thermophila漆酶的变体,研究发现尽管该变体羧基末端pI上升,但成熟蛋白的pI保持恒定(Zumárrage and Camarero et al.,2008)。研究人员假设,这些突变体可能促进了延伸的羧基末端与酶中心发生更高级的紧密结合,影响了蛋白质折叠,并作用于成熟蛋白。此类羧基端尾域是否对担子菌门漆酶有相同作用尚不清楚。Gelo-Pujic等人研究得出,当担子菌门漆酶TvL1GYC羧基末端截断了11个氨基酸后,酶的氧化还原电位发生改变,这表明羧基末端也可以影响担子菌门真菌漆酶的功能(Gelo-Pujic and Kim et al.,1999)。平菇漆酶POXA1b内发现了罕见延伸16个氨基酸的羧基末端,尽管在天然的和乳酸克鲁酵母异源表达的酶蛋白内均可见2~4个羧基末端氨基酸的加工。在定向改造实验的随机突变群体中,可以筛选到羧基端尾域发生突变的漆酶POXA1b。P494T突变体的羧基端形成多样且可移动的环。通过分子动态模拟这一突变体三维模型结构发现,突变影响了某些蛋白结构域的弹性,从而提高了酶的稳定性和活性(Giardina and Faraco et al.,2010)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







