酪氨酸酶与血蓝蛋白、儿茶酚酶具有相似的双核铜位点,其主要证据如下:(1)氧结合过程中可比较的价态和构象变化;(2)可比较的光谱学和磁性特点;(3)基本序列的同源性;(4)儿茶酚酶对4-羟基茴香醚表现出单酚酶活性;(5)在体外试验中,十二烷基磺酸钠或蛋白酶处理氧载体血蓝蛋白后能够表现儿茶酚酶活性,真菌酪氨酸酶具有的儿茶酚酶活性可能是源于酶活性中心对酚类物质具有较高亲和力(Halaouli and Asther et al.,2006)。
双孢蘑菇酪氨酸酶是由2条轻链和2条重链组成的分子量为120 kD的异四聚体。Robb和Gutteridge鉴定出Hα和Hβ两种重链形式,分别形成同工酶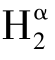 L2和
L2和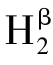 L2。从蘑菇子实体分离出来的Hα和Hβ这两种单体具有儿茶酚酶和甲酚酶活性,在自然条件下以47kD单链多肽的单体形式存在(Robb and Gutteridge,1981)。Wichers等人成功克隆建立了双孢蘑菇酪氨酸酶的全序列,该序列与蘑菇酪氨酸酶呈现出高度相似性。一般而言,酪氨酸酶具有3个结构域,其中包含双核铜结合位点的中心域分别称为CuA和CuB(Wichers and Bosch et al.,1995)。通常情况下,酪氨酸酶、儿茶酚氧化酶、软体动物血蓝蛋白和节肢动物血淋巴中的含铜氧载体中毗邻铜原子的氨基酸残基是高度保守的,且表现出序列的同源性。酪氨酸酶活性位点中6个保守的组氨酸残基与2个铜原子结合,同氧分子和酚类底物相互作用。半胱氨酸位点在形成二硫键中扮演重要角色,有利于稳定蛋白结构。不同生物体内半胱氨酸残基数目存在差异,在酶蛋白的氨基端和中心区域,人类和老鼠有17个半胱氨酸残基,植物则有11个,而羧基端只有1个残基位点;在双孢蘑菇、粗糙脉孢菌和原核生物酪氨酸酶的成熟蛋白内无或仅有1个半胱氨酸残基位点。在蘑菇酪氨酸酶序列的羧基端仅有2个半胱氨酸残基位点被报道过,而抑制剂或激活剂通过结合这类位点调节酶活性。为确定多种配体对双核铜结合位点的可接近性,研究者展开了基于多种复合物(CN—、酚类、叠氮化合物和含羞草素)的动力学研究,结果表明,相比小型的配体,大配体与酶活性位点具有更高的亲和力,这一点也被该酶具有多种大型底物/抑制剂所复证。
L2。从蘑菇子实体分离出来的Hα和Hβ这两种单体具有儿茶酚酶和甲酚酶活性,在自然条件下以47kD单链多肽的单体形式存在(Robb and Gutteridge,1981)。Wichers等人成功克隆建立了双孢蘑菇酪氨酸酶的全序列,该序列与蘑菇酪氨酸酶呈现出高度相似性。一般而言,酪氨酸酶具有3个结构域,其中包含双核铜结合位点的中心域分别称为CuA和CuB(Wichers and Bosch et al.,1995)。通常情况下,酪氨酸酶、儿茶酚氧化酶、软体动物血蓝蛋白和节肢动物血淋巴中的含铜氧载体中毗邻铜原子的氨基酸残基是高度保守的,且表现出序列的同源性。酪氨酸酶活性位点中6个保守的组氨酸残基与2个铜原子结合,同氧分子和酚类底物相互作用。半胱氨酸位点在形成二硫键中扮演重要角色,有利于稳定蛋白结构。不同生物体内半胱氨酸残基数目存在差异,在酶蛋白的氨基端和中心区域,人类和老鼠有17个半胱氨酸残基,植物则有11个,而羧基端只有1个残基位点;在双孢蘑菇、粗糙脉孢菌和原核生物酪氨酸酶的成熟蛋白内无或仅有1个半胱氨酸残基位点。在蘑菇酪氨酸酶序列的羧基端仅有2个半胱氨酸残基位点被报道过,而抑制剂或激活剂通过结合这类位点调节酶活性。为确定多种配体对双核铜结合位点的可接近性,研究者展开了基于多种复合物(CN—、酚类、叠氮化合物和含羞草素)的动力学研究,结果表明,相比小型的配体,大配体与酶活性位点具有更高的亲和力,这一点也被该酶具有多种大型底物/抑制剂所复证。
蛋白内双核铜区域中每一个铜原子均与3个咪唑残基相结合,这些配位体在CuA中命名为HA1、HA2、HA3,CuB中命名为HB1、HB2、HB3,并遵循排列通则HA1-x(n)-HA2-x(8)-HA3和HB1-x(3)-HB2-x(n)-HB3(n代表可变氨基酸残基数,x为其他氨基酸残基,H表示组氨酸)。考虑到儿茶酚氧化酶的晶体学数据以及对粗糙脉孢菌和双孢蘑菇酪氨酸酶的结构预测,Garcia-Borron和Solano将酪氨酸酶活性中心描述为被包含6个咪唑残基的四联体螺旋束螺旋定界的亲水球体,该亲水球体可能包裹在一个疏水性外壳下,这样的疏水性外壳属芳香性化合物,且由高度保守的氨基酸残基形成,分 别 是F(HA3-4)、Φ(HA3-1)和Φ(HA3+3)包 裹CuA,F(HB3-4)和H(HB3-1)包裹CuB,其中Φ代表任一芳香型氨基酸(W、F和Y)(García-Borrón and Solano,2002)。在这样的排布分列下,酪氨酸酶活性位点的结构基本上依赖静电力或阳离子-π(指阳离子和芳香体系之间的作用力)的作用来维护。这些非共价结合力是位于接近亚铜中心的几个残基相互作用的结果,此类残基包括Φ(HA1-7)、R(HA3+1)、Φ(HA3+3)、Φ(HA3+7)、E(HA3+8)、D(HB3-7)、D(HB3+4)、Φ(HB3+7)和W(HB3+10)。对比酪氨酸酶的最初结构,可以发现以下保守氨基酸:Φ(HA1-7)(Φ对应F或Y)、R(HA3+1),Φ(HA3+3)(Φ对应Y)、E(HA3+8)、D(HB3-7)、D(HB3+4)和W(HB3+10)。酪氨酸酶双核铜中心的另一个结构特点是具有高度保守的C(HA2-2),该残基参与CuA配体H2A形成硫醚键,这种半胱氨酸-组氨酸共价桥在软体动物血蓝蛋白亚基和甘薯儿茶酚氧化酶中被报道过(Klabunde and Eicken et al.,1998)。Lerch认为,对于粗糙脉孢菌的酪氨酸酶而言,这种不同寻常的硫醚键是酶分子内结构重排过程中形成的,并导致前酪氨酸酶的激活(Lerch,1983)。但Nakamura等学者认为,这样的硫醚键在米曲霉酪氨酸酶内参与了C(HA2-2)与CuA原子的结合(Nakamura and Nakajima et al.,2000)。Klabunde等学者推测这类结构有助于优化邻苯二酚氧化中铜中心的氧化还原电位,能够在氧化还原过程中实现快速的电子传递(Klabunde and Eicken et al.,1998)。(https://www.daowen.com)
由于酪氨酸酶较高的疏水性,想要获得具有活性的酪氨酸酶晶体非常困难。事实上,膜蛋白在较高的浓度下很难溶解,因此如果没有蛋白抗体的协助,膜蛋白很难结晶。在伴侣蛋白ORF378的协助下,有学者获得酪氨酸酶的晶体,并确定了铜结合的和不含铜的酪氨酸酶-ORF378复合体的晶体结构。这一伴侣蛋白协助两个Cu(II)离子转运至酪氨酸酶催化中心。伴侣蛋白覆盖在酪氨酸酶的疏水分子表面,干扰底物酪氨酸与酶活性中心的结合。伴侣蛋白包含一个6束的β-折叠和一个α-螺旋,与蛋白质数据库里的所有蛋白都没有相似性。虽然酪氨酸酶和儿茶酚氧化酶都归于3型铜蛋白家族,后一种酶缺乏单加氧酶活性。在活性中心的差别主要是基于结构方面,在酪氨酸酶的活性中心上方有一个巨大的空间,6个组氨酸配体中的一个高度自由,并与双铜结合。这一结构表明,在催化单酚的邻位羟基化过程中,Cu(II)与来源于过氧化氢的氧原子相配位,并结合底物。在整个催化过程中,双铜中心都是高度灵活的(Matoba and Kumagai et al.,2006)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







