1.2.4.1 光谱表征
在CO和TYR的金属过渡态(met态)(Cu(II)-Cu(II)),两个铜原子为反铁磁耦合(-2J>600cm-1),其S=0的EPR基态,这是3型铜的特征。Cu(II)-Cu(II)的典型EPR信号仅在蛋白质变性的情况下才能被检测出(Eicken and Zippel et al.,1998)。蓝色的氧化态(oxy态)是当结合了氧分子或过氧化氢,其特征最大吸收峰在343nm处(∈=6500 cm-1M-1),是由O22-(πσ×)→Cu(II)电荷转移引起以及在580 nm处(∈=450 cm-1M-1),是由O22-(πv×)→Cu(II)电荷转移引起。两种消光系数都以甘薯儿茶酚氧化酶的铜原子为例(Eicken and Zippel et al.,1998)。还原态的Cu(I)-Cu(I)(deoxy状态)没有显示出反铁磁耦合的双铜原子,也没有桥接原子。
黑杨树叶(Populus nigra)中氧化态CO的共振拉曼光谱在277cm-1有最强峰。这一观察与oxyTYR和oxyHC的紫外共振拉曼光谱一致,其中对应的峰值是由Cu-Nax(轴向位的组氨酸)的拉伸振动模式引起(Rompel and Fischer et al.,1999)。
根据延伸X射线吸收精细结构(EXAFS)的测量数据,甘薯CO的Cu-Cu距离为2.9Å(met态),并且与含有3个组氨酸以及每个铜一个氧的配位层一致。对于甘薯CO的oxy态,EXAFS测量显示Cu-Cu距离为3.8Å,并与5个N/O原子配位。链孢霉(Neurospora crassa)TYR的EXAFS和X射线吸收近边结构(XANES)光谱数据显示,Cu-Cu距离为3.6Å(Solomon and Sundaram et al.,1996)。
链霉菌属(Streptomyces antibioticus)TYR的1H NMR谱表明,每个铜原子与3个组氨酸残基的N∈配位(Bubacco and Salgado et al.,1999)。结合氯化物的TYR也检测到,但这种结合的性质尚未明确。
1.2.4.2 模型化合物模拟的3型铜中心的性能
模型化合物对于阐明氧分子与铜中心之间的结构模式(即氧化态铜中心)非常重要。有学者认为,氧分子的结合位点在过氧化物氧化态,可能以顺-μ-η1:η1(O22-桥为一个分子)桥接或以μ-η2:η2(O22-位于两个铜原子之间,见图1-5)桥接。前者模式是在一个模型化合物中发现(Karlin and Kaderli et al.,1997),而后者是使用[Cu(HB(3,5-i-Pr2pz)3]2(O2)模式(见图1-5(a))(Kitajima and Moro-oka,1994)。该第二模型化合物的抗磁性和光谱行为类似于oxy HC。最后,从鲎(Limulus polyphemus)oxyHC的X射线结构分析证实í-è2:è2的结合模式是正确的(见图1-5(b))(Magnus and Ton-That et al.,1994)。(https://www.daowen.com)
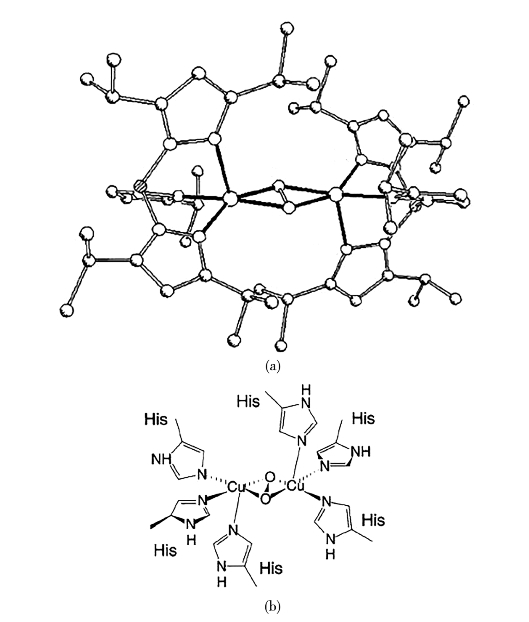
图1-5 模型化合物(a)和美洲鲎血蓝蛋白晶体结构(b)中的双氧结合模式(Gerdemann and Eicken et al.,2002)
随着模型化学的发展,我们可以得到模型化合物的晶体结构,该结构在室温下稳定,且能可逆地结合分子氧,从而再现了HC的性能(Kodera and Katayama et al.,1999)。复合体作为TYR功能模型也可以被结晶。起初,能够羟化的芳环配体的模型化合物被报道(Karlin and Kaderli et al.,1997;Kodera and Katayama et al.,1999)。之后,具有单酚酶和二酚酶活性的其他模型化合物分别被结晶(Monzani and Battaini et al.,1999)。与此相反,对3,5-对叔丁基邻苯二酚的儿茶酚酶活性(无单酚酶活性),可以使用若干种模型化合物进行模拟。对四氯邻苯二酚催化晶体的结构为双齿结合模式,可以作为研究儿茶酚氧化机理的中间体的模型。然而,到目前为止,所有模型化合物的酶转换率远远低于天然酶(Karlin and Kaderli et al.,1997)。
1.2.4.3 双铜中心的调节
光谱数据表明,酪氨酸酶的双铜催化位点,参与皮肤黑色素的生物合成,结构上类似于儿茶酚氧化酶和血蓝蛋白(Solomon and Sundaram et al.,1996)。采用定点诱变的方法,六配位的组氨酸残基已被鉴定(Jackman and Hajnal et al.,1991)。人类酪氨酸酶和甘薯儿茶酚氧化酶的序列比对显示,这两种酶在383个残基区域(含六个金属配位体)保守,表现为26%的序列同一性,如图1-4所示。因此,儿茶酚氧化酶的双金属中心可以作为酪氨酸酶的催化双铜中心的结构模型。然而,儿茶酚氧化酶没有显示单加氧酶活性,而酪氨酸酶表现出单加氧酶和氧化酶活性。在活性位点区的突变和在双金属中心的小的结构变化,造成了不同的特异性和功能,来达到调整3型铜中心的特定目的。例如,Glu 236在儿茶酚氧化酶催化的二酚氧化反应中用作广义碱/酸,在人类酪氨酸酶中是谷氨酰胺,在粗糙脉孢菌(N.crassa)的酪氨酸酶中是亮氨酸。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







