某研究确定了47个物种的PPO序列(来自于动物、植物、真菌和细菌),结果表明PPO序列的巨大差异几乎无法在物种间进行分类(Malviya and Srivastava et al.,2011)。但值得注意的是,PPO家族的共性在于所有成员的催化位点有高度序列同源性(Decker and Schweikardt et al.,2006),因此暗示这些成员在进化上有共同的祖先。
植物CO的cDNA由3个翻译区域组成,一个是编码9 kD的通向叶绿体的转运肽,一个成熟蛋白和一个未知功能的附加C-末端延伸肽。这个约15 kD的C-末端延伸肽在纯化过程中会被裂解(Mayer and Harel,1979)。负责裂解该肽的蛋白质目前没有被鉴定出来,而且其功能和裂解的控制机制仍不清楚。从细菌TYR也发现类似的C-末端延伸肽,目前认为延伸肽的裂解会激活酶(Van Gelder and Flurkey et al.,1997)。
PPO基因在细胞质中合成含有信号肽的前体肽,大小为60~75 kD。PPO包括3个结构域:一个N端8~12 kD的信号肽,一个中部高度保守的Cu结合区和一个C端疏水结构区(Tran and Taylor et al.,2012)。两个高度保守的铜结合区CuA和CuB负责铜与氧分子和酚类底物的协调联动。相关研究表明,大多数PPO含有信号肽,它可将PPO蛋白锚定于类囊体腔(Steffens and Harel et al.,1994)。只有金鱼草(Antirrhinum majus)的PPO前体肽N端序列不具信号肽结构,且PPO定位于液泡(Nakayama and Yonekura-Sakakibara et al.,2000;Ono and Hatayama et al.,2006)。
从蛋白质的生物来源来看,7个不同来源的域已被识别,如图1-3所示。高等真核生物和植物的TYR和CO具有全部的3个结构域,仅在编码C-末端延伸肽的某些特性区域有所不同。真菌和细菌的TYR缺少一个转运肽的编码域(Van Gelder and Flurkey et al.,1997)。此外,细菌的TYR具有较短序列,这导致成熟蛋白质的分子量<30 kD。昆虫和甲壳动物的TYR和CO与前面提到的4种不同,但与节肢动物的血蓝蛋白是相关的。它们还存在潜伏形式,但不同于植物CO,它们通过N-末端区的裂解而被激活。相对于前述的TYR和CO,这两类HC还显示出一些附加区域。
不同植物的CO具有40%~60%的序列同一性。植物CO和软体动物HC之间的序列同一性(约超过几乎整个序列长度的35%)也是值得一提的。与此相反,非植物来源的其他3型铜蛋白和植物CO之间的序列同一性仅限于两个铜结合的区域。
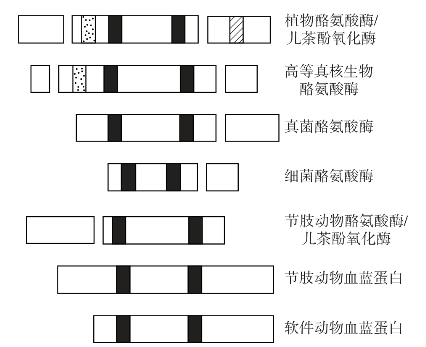
图1-3 3型铜蛋白的一级结构。片段的长度与氨基酸残基的数量成正比。铜结合区中高组氨酸区用黑色块标记,高半胱氨酸区用黑点标记,植物儿茶酚氧化酶的C端延伸区中额外的高组氨酸区用斜杠标记(Gerdemann and Eicken et al.,2002)。(https://www.daowen.com)
基于酪氨酸酶蛋白全序列的进化分析显示,真菌酪氨酸酶成簇地分布于担子菌门、子囊菌门和半知菌门中。这些观察结果基于数量资料的同一性,例如血红密孔菌与漏斗多孔菌、香菇菌酪氨酸酶表现出极高的同一性(分别为67%和56%)(Morinaga,2003)和相似性(分别为75%和67%)(Sato,2001)。通过比较担子菌门内血红密孔菌、漏斗多孔菌、香菇菌和双孢蘑菇菌、半知菌门内烟曲霉和米曲霉以及子囊菌门内粗糙脉孢菌和柄孢壳菌属的酪氨酸酶全序列,发现它们在最初的300个氨基酸残基内具有重要的相似性,这与铜结合区域(含3型铜金属蛋白内高度保守的中心区域)相吻合。过去10年内,已分离出多个编码真菌酪氨酸酶的基因,它们在基因长度、外显子数量和同源性上存在高度异质性,例如血红密孔菌酪氨酸酶与其他担子菌门真菌的酪氨酸酶核苷酸序列同源性较低,该酶分别与香菇菌51%同源,与漏洞多孔菌17%同源,与双孢蘑菇菌仅7%同源(Halaouli and Asther et al.,2006)。
两个铜结合的区域在所有3铜类型的蛋白质都表现出最高度的保守。尤其是CuB的结合区域是高度保守的,而CuA结合区域显示出更多的序列多样性,并因此造成TYR,CO和HC的不同的功能表现(Van Gelder and Flurkey et al.,1997)。两个铜配位区如图1-4所示。
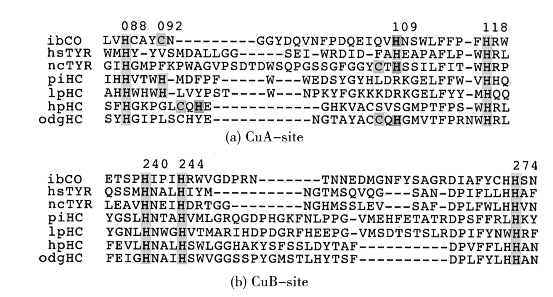
图1-4 甘薯儿茶酚氧化酶(ibCO),人类酪氨酸酶(hsTYR),粗糙脉孢菌酪氨酸酶(ncTYR),断沟龙虾血蓝蛋白(piHC),罗马蜗牛血蓝蛋白(hpHC)以及北太平洋巨型章鱼(odgHC)的序列比对。CuB区域高度保守,载氧蛋白、单加氧酶和氧化酶的CuA区域则各不相同(Gerdemann and Eicken et al.,2002)。
3种类型的3型铜酶彼此密切相关。这也由一个事实所证实,即某些HC有弱儿茶酚酶活性或可被蛋白水解活化以诱导这种活性(Van Holde and Miller,1995)。弱儿茶酚氧化酶活性经常被发现于软体动物和节肢动物的HC中,例如,章鱼(Octopus vulgaris)HC以及被胰蛋白酶或胰凝乳蛋白酶水解部分消化后的狼蛛HC。在狼蛛HC中,Decker和Tuczek认为其激活作用是因其N端区域的蛋白水解的结果(Decker and Tuczek,2000)。此外,如上所述,一些植物CO显示出弱甲酚酶活性,其底物为特殊的一元酚,如4-羟基茴香醚(4-hydroxyanisole)。此活性常常在纯化过程中损失,可能是由于在活性位点的结构变化引起。HC,TYR和CO也被检测出弱的过氧化氢酶的活性,即过氧化氢的歧化反应(Gerdemann and Eicken et al.,2001)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








