1)原理
Ag/AgCl电极属于金属/金属难溶盐电极,主要由金属、金属难溶盐及与金属难溶盐具有相同阴离子的可溶性盐溶液组成。该类型电极在进行反应时,金属阳离子参加氧化还原反应,而阴离子只在固/液界面进行溶解和沉积(生成难溶盐)。Ag/AgCl电极在海水中存在Ag/AgCl/Cl-两个相界面,主要由金属Ag、固体AgCl和含有可溶性氯化物的电解液组成。电极处于平衡状态时,氧化反应和还原反应速度相等,电极净反应速度为零,反应可表示为
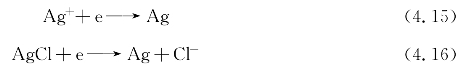
AgCl虽然是一种难溶物质,但在海水中仍有一定的溶度积,因此电极表面存在另一个平衡关系:
![]()
根据能斯特(Nernst)方程可得到平衡状态的电极电位φ平:

式中 φ0——标准电极电位;
R——理想气体常数;
T——环境绝对温度;
n——参加反应的电子数;
F——法拉第常数;
CO——氧化剂浓度;
CR——还原剂浓度。
式(4.18)中的平衡电极电位φ平可表述为
![]()
由于式(4.17)不得失电子,根据AgCl的溶度积

所以Ag/AgCl电极的平衡电位φ平为

综上所述,在Ag/AgCl电极反应中,实际参与氧化还原反应的是Ag+,而在固/液界面上溶解和沉积的是Cl-。Ag/AgCl电极本质上是对Ag+可逆的,但由于Ag+的活度受到Cl-活度的制约,因此电极的平衡电位主要依赖于Cl-的活度。
Ag/AgCl电极的化学反应是一个可逆的过程,其氧化还原反应处于一个动态平衡状态,而电极电位的稳定性取决于氧化、还原过程的物质浓度变化率。AgCl作为一种难溶性盐,在海水中分解为Ag+和Cl-的速度慢,减缓了电极表面反应粒子浓度的变化,提高了电极电位的稳定性。而且海水中参与导电的离子为氯离子,与Ag/AgCl电极中的Cl-为同一种物质,确保了Ag/AgCl电极在海水中的长时间稳定性。
2)噪声分析
可逆电极中当电荷交换和物质交换处于动态平衡状态时,其净反应速度为零,此时的电极电位为平衡电位。如果有电流通过电极界面,电化学平衡会发生偏离,电极电位偏离平衡电位,产生极化现象,形成极化过电位,用符号η表示:
![]()
式中 η——电极极化程度;
φ——电极电位;
φ平——平衡电位。
与此同时,由于可逆电极的自身反应存在使偏离电位逐渐恢复平衡状态的趋势,即去极化作用。电极的净反应速度可以用巴特勒-伏尔摩(Butler-Volmer)方程来表述:

式中 i——电极的净反应速度(或称为极化电流密度);
i0——电极反应的交换电流密度,即在平衡状态下氧化态和还原态粒子在电极/溶液界面的交换速度;
η——电流通过电极时的极化过电位;
α——电子传递系数,与电极电位和活化能有关。
从式(4.24)可以得出,电极发生极化现象时,交换电流密度i0越大,电极的净反应速度i越快,电位偏离平衡的程度越弱,即去极化作用越强。换句话说,电极极化时的过电位大小取决于极化电流密度i和交换电流密度i0的相对大小,当极化电流密度i不变时,交换电流密度i0越大,极化过电位η越小。
由于金属Ag的交换电流密度远远大于其他常用金属,在极化电流密度较小时,Ag/AgCl电极可认为是理想不极化电极。当海底微弱电场信号经过Ag/AgCl电极界面时,由于电极的净反应速度很大,以至于去极化作用与极化作用平衡,电极反应在接近平衡电位的条件下进行,电极电位几乎不变化,这对水下微弱电场信号的检测无疑是有利的。
电极由平衡状态被电流破坏到重新建立平衡状态的过程,可以用图4.16a所示的等效电路模型来表示。在Ag/AgCl电极反应中,法拉第阻抗Zf用电极/溶液界面的电荷传递电阻Rct来替代,其等效电路模型简化为图4.16b。(https://www.daowen.com)

图4.16 电极的等效电路模型与简化模型
由图4.16a可以看出,电极上的电流分为两部分:一部分为法拉第电流if,该电流来源于电极表面电化学反应的电荷传递;另一部分为非法拉第电流ic,是由双电层电荷改变产生的电流。
对于Ag/AgCl不极化电极,外电路流向界面的电荷对双电层结构无影响,全部作用于界面的电化学反应,从而维持快速的反应速度。当极化电流密度i远远小于交换电流密度i0,即过电位η很小时,式(4.24)按级数形式展开,可得
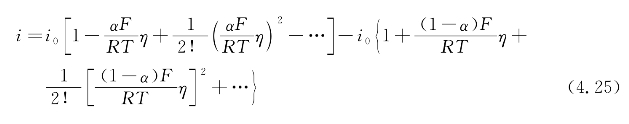
由于|η|很小,则

式(4.25)级数展开式只保留前两项,得到低电位下的近似公式:

由式(4.29)可以看出,极化过电位η与净反应速度i或交换电流密度i0呈线性关系。由此得到电极/溶液界面的电荷传递电阻Rct的表达式:

由式(4.30)可以得出,电荷传递阻抗Rct与交换电流密度i0成反比关系,交换电流密度i0越大,电极/溶液界面的电荷传递电阻Rct越小。由于Ag的交换电流密度i0较大,电荷传递电阻Rct小,这有利于电荷在电极/溶液界面的传递。
3)制作工艺
目前Ag/AgCl电极制备工艺有粉末冶金法、电解法和热分解法。其常用制备方法如下所述:
(1)粉末冶金法。基本工艺是将Ag粉和AgCl粉末材料通过模具加压使电极成型,然后放在高温下烧结,烧结完经盐酸活化处理,与银棒进行连接即得到固态Ag/AgCl电极。
(2)电解法。将银丝经过处理后放入电解液中进行阳极氧化,用铂丝做阴极,在电解池中通入一定的电流,电解一段时间后,即可得到氧化后的Ag/AgCl丝。Ag/AgCl丝经过加工后得到Ag/AgCl电极。
(3)热分解法。利用加热分解的方法直接制得Ag粉和AgCl粉混合物,将铂丝上涂有一定比例的Ag2O和AgClO3的混合物,在坩埚炉中高温加热,使混合物分解成为Ag和AgCl,该电极在稀HCl溶液中具有稳定的电位。
粉末冶金法和热分解法是由Ag与AgCl粉末经提纯、高温烧结工艺得到,有较好的均匀性和稳定性,关键技术在于制备合适的AgCl粉末,其电化学特征直接影响电极噪声,不足之处在于工艺步骤复杂,成本较高,各环节参数不易控制,成品率较低。区别于粉末冶金法,电解法的关键步骤在于通过电解法在一定面积的银箔基体表面沉积一层致密、均匀的AgCl,并为银箔包裹保护罩、引出连接线、解决水密问题。经验证,此工艺成品率较高。采用电解法工艺制备Ag/AgCl电极,依次经过引线、密封、组装等步骤制作水下电场传感器。
电解法制备Ag/AgCl电极的过程主要包括三个步骤:电极芯的制备、电极的阳极氧化(电解)、电极装置的承压密封。Ag/AgCl电场传感器主要由传感器主体、传感器腔体、传感器保护罩和水密接插件组成,其结构示意图如图4.17所示。涂有AgCl的银片通过多孔管与海水进行离子交换;多孔管主要起到透水与物理保护的作用;水密接插件实现海底电场信号与低噪声放大器之间的水密传输。

图4.17 海底电场传感器结构图
抛光粉打磨银线和银管,并依次用丙酮、稀硝酸溶液、去离子水超声清洗。银管与银线一端硬连接,另一端固定在电极管底部,银管内部及银管和电极管之间分别填满AgCl粉末和硅藻土的混合物。环氧树脂密封电极管顶部,得到电极芯,并将电极芯浸入蒸馏水中保存。
在室温环境下,对电极芯进行阳极氧化,电解质溶液采用3.5%的NaCl溶液,整个过程在暗室内进行。电极芯作为阳极参与反应,另一纯净的银箔放入电解质溶液中,作为阴极参与反应。电解原理示意图如图4.18所示。
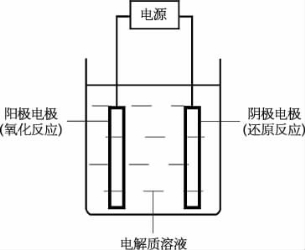
图4.18 电解原理示意图
电解时通入恒定的电流,银管和银箔分别发生氧化还原反应,银管表面产生一层均匀致密的AgCl物质,银箔表面产生大量气泡。
电解过程中阳极发生氧化反应,其反应式为

阴极发生还原反应,其反应式为
![]()
电解一段时间后即可得到Ag/AgCl电极,电解完的Ag/AgCl电极放入盛满NaCl溶液的密闭容器内避光保存。
信号传输接插件引线与Ag/AgCl电极芯引线冷焊接,并通过传感器腔体固定连接,接触面通过环氧树脂密封,确保与海水隔离。电极芯置于电极保护罩内,缓冲物质置于电极芯与电极保护罩之间,信号传输接插件用O形圈与传感器腔体顶端密封,电极保护盖固定于电极保护罩底部,得到完整的电场传感器装置。
制作的电极实物如图4.19所示。电极典型指标为初始极差小于100μV,极差漂移优于20μV/d,内阻约5Ω@10 Hz。

图4.19 电极实物图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







