对于电化学腐蚀来说,无论是自由能变化,电极平衡电位,还是电位——pH图,都只能够作为判断是否发生腐蚀,以及腐蚀倾向大小的依据,不能作为表示腐蚀速率大小的度量。但对于腐蚀我们往往不仅关心进行的方向和限度,更注重腐蚀的速率。是否腐蚀倾向越大腐蚀速率就越大呢?要回答这一问题,仅用热力学知识显然无法给出解释,我们必须借助另一研究范畴——腐蚀动力学。
1.腐蚀速率与极化作用
电化学腐蚀通常是按照原电池作用的历程进行的,作为腐蚀电池的电极本身既是传递电子的介质,又是电化学反应的反应点。为了使这个反应在一定电位下得以在电极与溶液界面间顺利进行,不可避免地会涉及某些与之有联系的物理和化学变化。通常将电流通过电极与溶液界面时所发生的一连串变化的总和,称为电极过程。
对于图14-4的一个腐蚀电池来说,在外电路接通的瞬间可以观察到有很大的起始电流,但很快下降,几分钟后达到稳定,稳定电流只有起始值的几十分之一。电极电位随时间的变化关系如图14-5所示,电路接通后阳极电位逐渐增大,阴极电位逐渐减小,两极间的电位差急剧下降,当电流到达稳定值时,两极间的实际电位差降为Ec-Ea。该实际电位差决定了腐蚀电流的大小,从而决定了腐蚀速率。
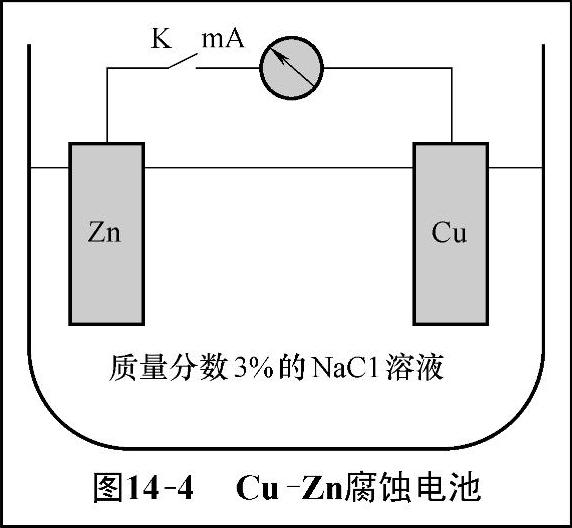
图14-4 Cu-Zn腐蚀电池
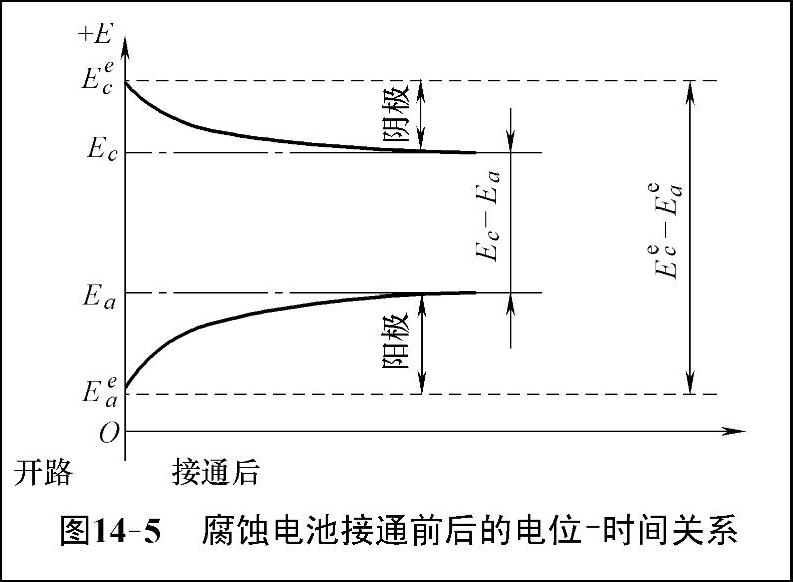
图14-5 腐蚀电池接通前后的电位-时间关系
由于电流流过电极,电极失去平衡,引起电位差发生变化的现象叫做极化作用。极化作用使电池两电极间的电位差减小,并引起工作电流强度降低,从而减缓腐蚀速率,由此可见极化是决定腐蚀速率的主要因素。随着电流通过,阳极电位向正方向移动的现象叫阳极极化;阴极电位向负方向变化叫阴极极化。有电流通过而发生的电极电位偏离于原电极电位的变化值称为过电位。
极化作用可以减小腐蚀电流,减缓腐蚀速率,是一种有益的作用。我们把消除或减弱阳极和阴极极化作用的过程称之为去极化作用。消除或减弱极化作用的物质,称之为去极化剂。
2.极化曲线与腐蚀极化图
电极电位的变化与通过的电流密度密切相关,随着电流密度的增加,阳极电位沿着曲线Ea0A向正方向移动,阴极电位沿着曲线Ec0C向负方向移动。把表示电极电位与极化电流或极化电流密度之间的关系曲线成为极化曲线,如图14-6所示。
极化曲线对于解释金属腐蚀的基本规律有着重要意义,极化曲线的形状可反映出电极反应过程进行的难易程度,曲线越陡电极反应阻力越大,反之曲线越平坦极化反应越容易进行。
把构成腐蚀电池的阴极和阳极的极化曲线绘在同一个E-I坐标图上,即得到腐蚀极化图。如图14-7所示,电流强度I为横坐标,电位E为纵坐标,图中使阴、阳极共同达到的电位成为腐蚀电位。在金属腐蚀研究中经常用腐蚀极化图来腐蚀过程的影响因素和腐蚀速率的大小。
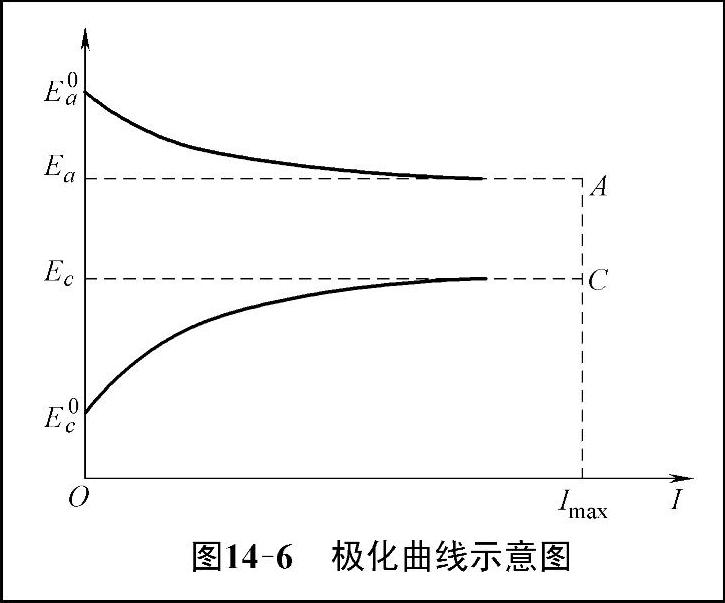
图14-6 极化曲线示意图(https://www.daowen.com)
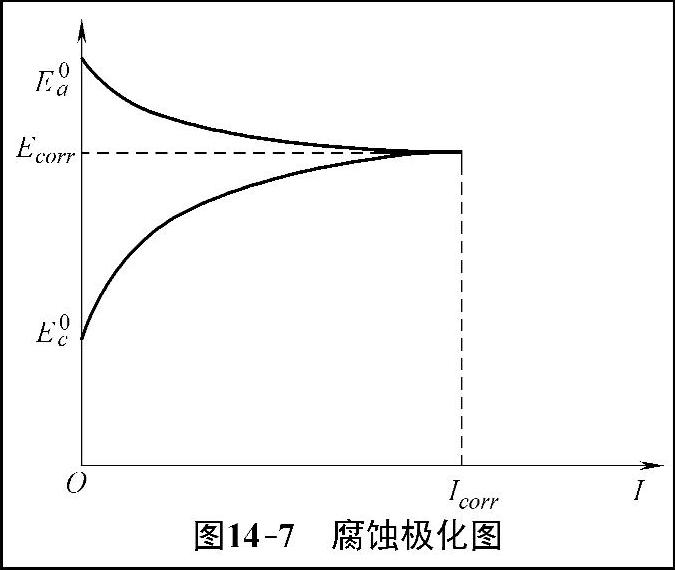
图14-7 腐蚀极化图
略去电位随电流变化的详细过程,将极化曲线简化成直线,得到的极化图就称为伊文思(Evans)极化图,如图14-8所示。图中阴极极化率
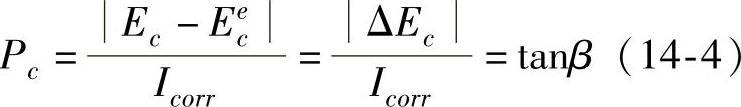
阳极极化率
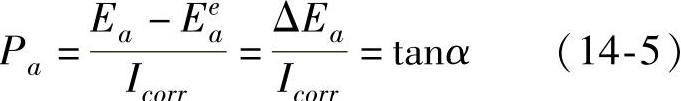
腐蚀电流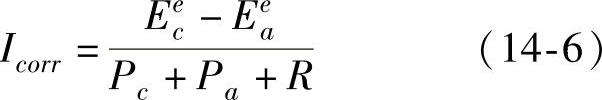
这种简化的腐蚀极化图是由英国科学家伊文思(R.Evans)在2026年首先提出并应用的,而伊文思极化图就是典型的理想极化曲线图。图中阴、阳极极化曲线的起点是它们各自的理想电极的平衡电位,把这种以平衡电位为起始电位画出的极化曲线叫做理想极化曲线。从腐蚀电位开始用外加电流进行阴极极化和阳极极化,即可得到实测极化曲线。当外加电流很大时,实测极化曲线就与理想极化曲线开始重合,故而可利用这一关系得到理想极化曲线。
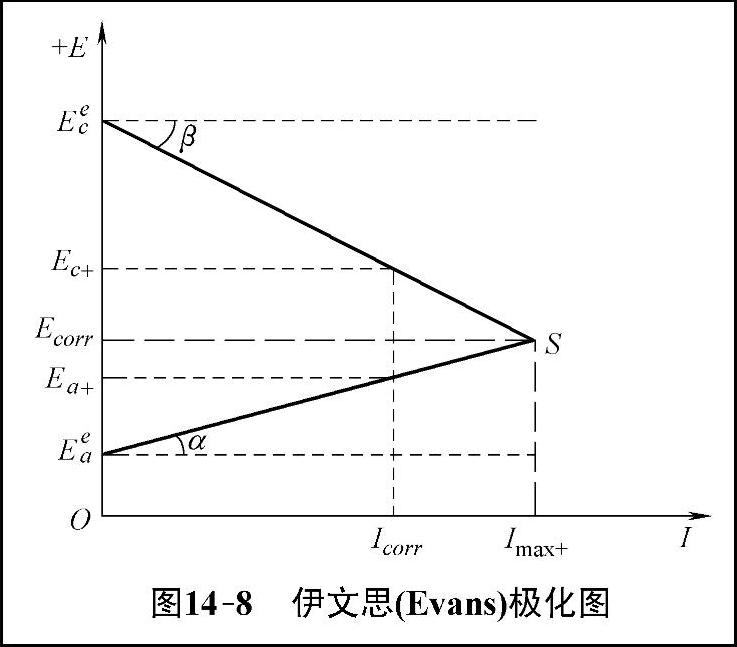
图14-8 伊文思(Evans)极化图
3.电化学腐蚀过程的控制因素
我们知道热力学主要研究腐蚀原因及腐蚀倾向的问题,而动力学则着重于解决腐蚀速度问题。通过研究电化学腐蚀动力学问题寻找影响腐蚀反应速率的因素,并借助控制这些因素以降低腐蚀速度。由式(14-6)可以看出,腐蚀电池腐蚀电流的大小在很大程度上由Pc、Pa和R所控制,所有这些参数都可能成为腐蚀的控制因素。各个控制因素对整个腐蚀过程的控制程度,可用各控制因素的阻力与整个控制因素的总阻力之比的百分率表示。那么
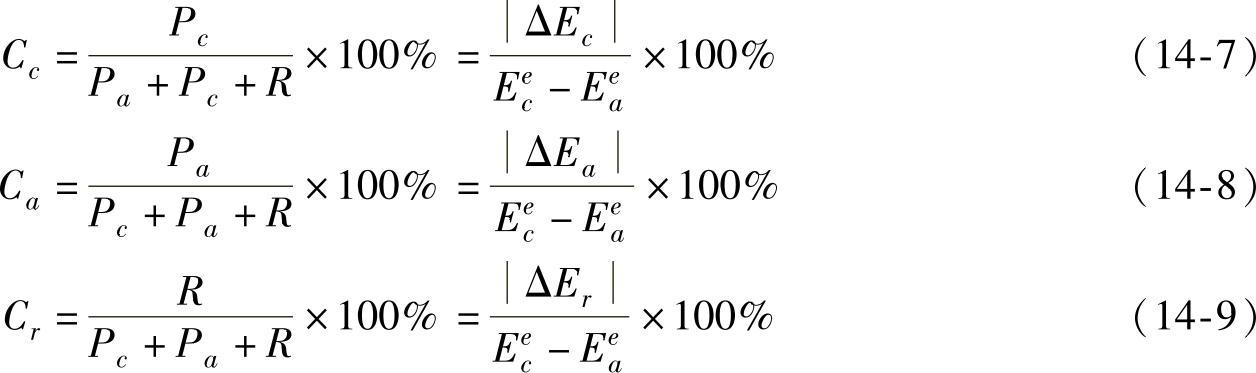
其中,Cc、Ca、Cr分别表示阴极极化控制程度、阳极极化控制程度、欧姆电阻极化控制程度。把控制程度最大的因素叫做腐蚀过程的主控制因素。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




