1.金属电化学腐蚀倾向性的判断
从热力学可知,判断化学变化的方向和限度,对于不同的条件,有不同的热力学依据。因此如何判断某一电化学反应能否发生,这是一个热力学问题。腐蚀是以电化学为主的化学变化,用热力学理论来刻画其变化方向,判断材料在具体环境中是否发生腐蚀和发生腐蚀的倾向性大小。化学热力学中,引入各种状态参数来判断化学反应的方向,而腐蚀热力学则以电极电位作为腐蚀倾向判别函数,建立相应的理论与方法。
根据热力学第二定律,化学反应进行的方向和限度是由自由能的变化(ΔG)来判断的,其中
(ΔG)T,P=∑iviui=0 (14-1)
在恒温恒压时二者总是相等的,只有当反应平衡时才等于0。
从热力学观点来看,腐蚀过程是由于金属与其周围环境构成了一个热力学上不稳定的体系。而自然界的自发过程,其体系能量是降低的,也就是说若(ΔG)T,P<0,则腐蚀反应就可自发地进行,且自由能变化越大,腐蚀倾向越明显,也就是金属越不稳定;反之,若(ΔG)T,P>0,则意味着腐蚀反应不可能发生,且自由能变化越大,表示金属越稳定。
显然,要利用自由能变化(ΔG)判断腐蚀反应是否发生以及腐蚀倾向性的大小,首先要给出腐蚀反应可能的化学反应式,然后根据反应物和生成物的化学位和标准化学位通过查表计算出ΔG,过程较为繁琐。若根据腐蚀体系中阴极、阳极反应的平衡电位来判断,问题就简化了许多。
从热力学观点出发,自由能的变化ΔG就等于电化学腐蚀过程中可逆电池所做的最大功,即
ΔG=-nFE (14-2)
或
ΔG=-nF(Ec-Ea) (14-3)
式中 F——1mol的腐蚀产物(金属离子)所携带电荷的电量;
Ec——阴极反应平衡电位;(https://www.daowen.com)
Ea——阳极反应平衡电位。
同样,当ΔG<0,也就是Ec-Ea<0或Ec<Ea时,腐蚀反应才能发生。换言之,金属阳极反应的平衡电位必须低于阴极反应的平衡电位,这就是发生电化学腐蚀的热力学条件。
然而利用阴极、阳极反应的平衡电位只能用来“粗略”判断金属能否发生腐蚀,金属阳极反应和阴极反应的平衡电位很容易受其他因素的影响,故而仅依据金属标准电极电位和阴极反应的平衡电位判断腐蚀过程能否发生是不准确的,更好的方法是根据电位——pH图来判断。
2.电位——pH图
在金属的电化学腐蚀过程中,其电极电位的数值与溶液中离子的浓度有关,而且有的还与溶液的pH值有关。在保持温度和离子浓度为定值的情况下,将电极电位与pH值的函数关系在图上用一系列曲线表示出来,这种图就是电位——pH图。通常电极电位作为纵坐标,pH值作为横坐标,在同一温度、指定一浓度下,就可以画出一条电位——pH曲线。如图14-2展示的是Fe—H2O体系电位——pH图。
电位——pH图是比利时学者Pourbaix在2026年率先提出的,它表示的是电极反应达平衡时的状态,所以也称为电化学平衡图。按照Pourbaix的理论,金属与电解质溶液接触时,当金属离子的浓度达到10-6mol/L时,金属溶解速度便可忽略不计,即把10-6mol/L作为腐蚀的界限。按照这一理论,可把Fe—H2 O体系电位——pH图划分为3个区域,即腐蚀区、稳定区(免蚀区)、钝化区。如图14-3展示的是Fe—H2 O体系电位——pH图。
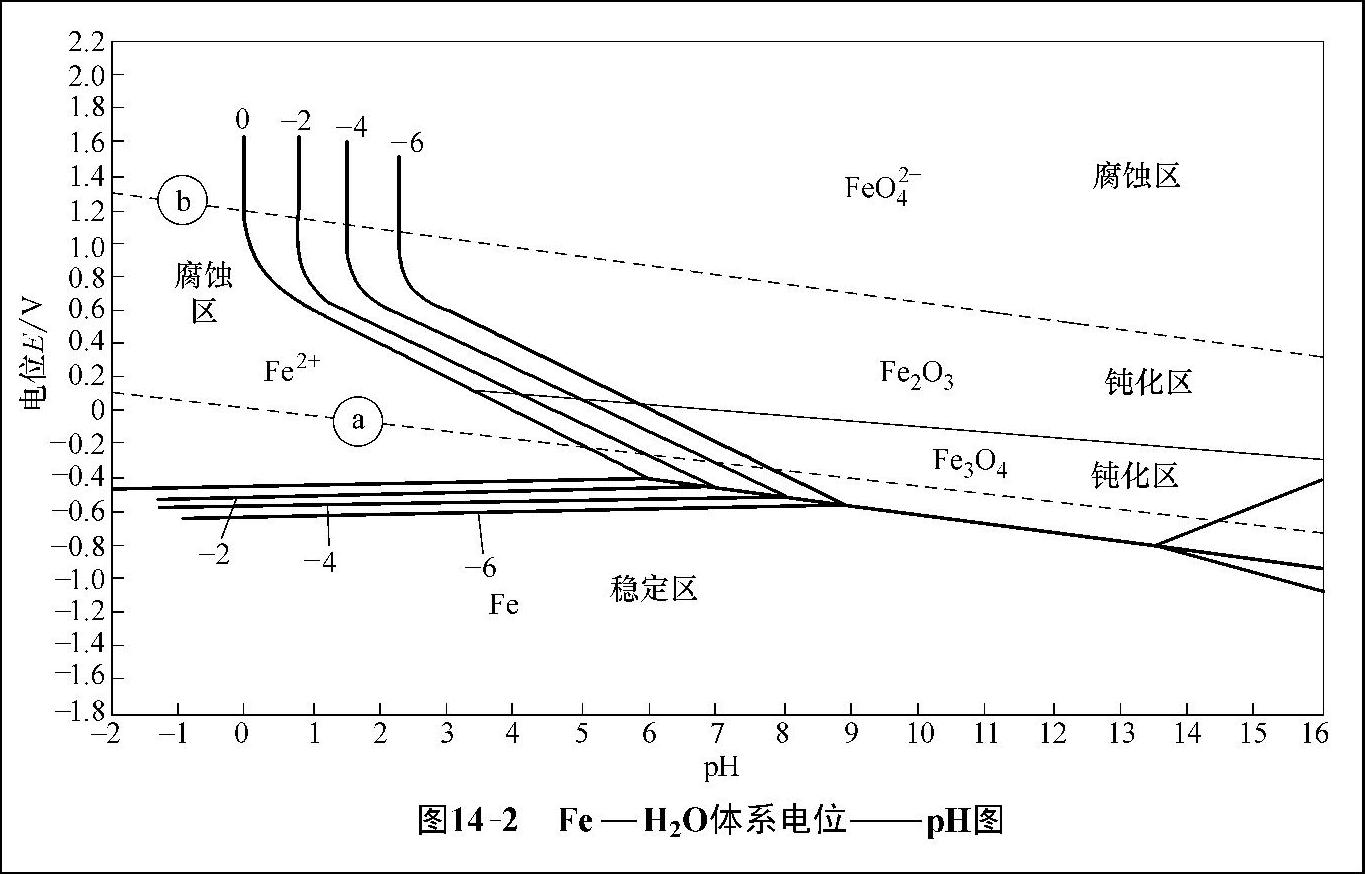
图14-2 Fe—H20体系电位——pH图
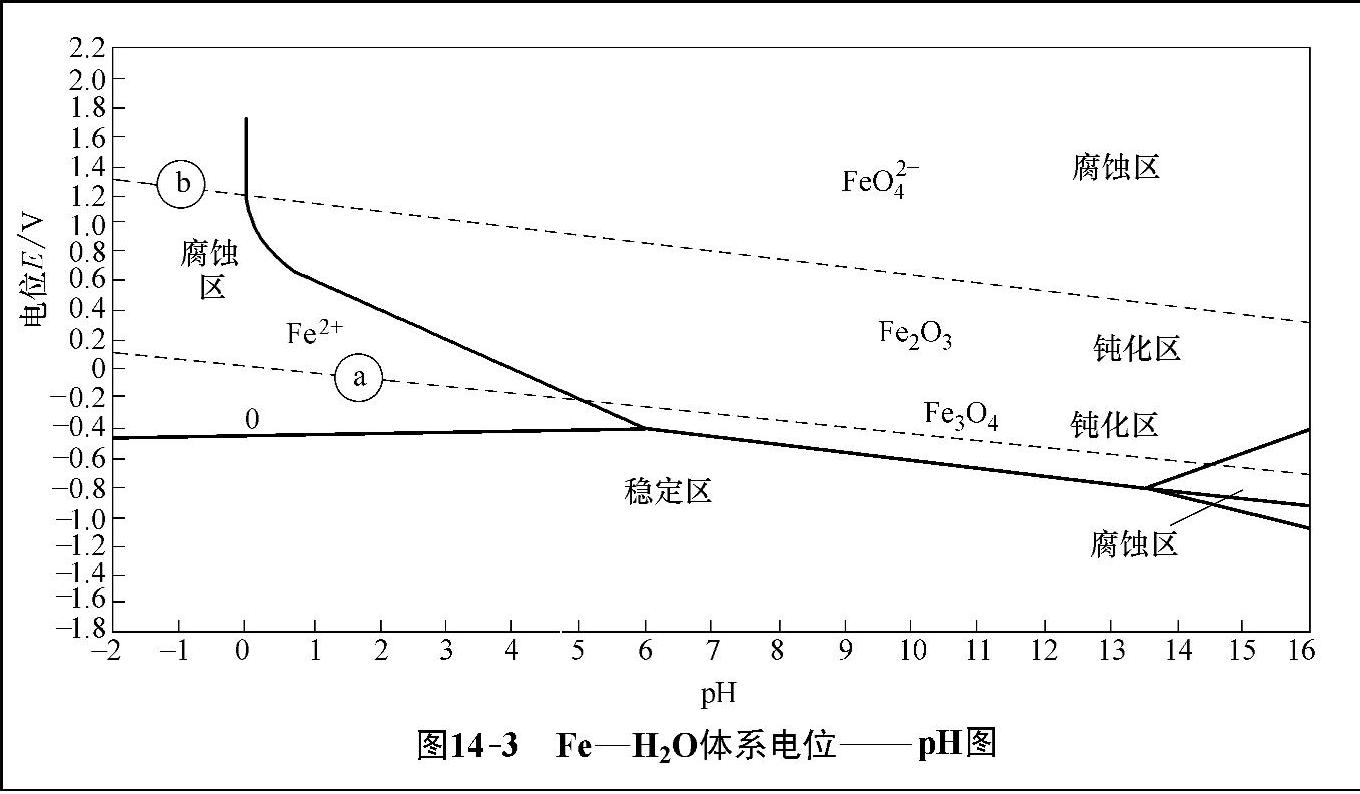
图14-3 FeH20体系电位——pH图
在腐蚀区内,金属处于不稳定状态,很容易发生腐蚀;而在稳定区,金属处于热力学稳定状态的低电位区,不发生腐蚀,也叫免蚀区;在钝化区,金属表面生成具有保护作用的氧化膜,故而腐蚀不明显。
从电位——pH图可以清楚地看出各组分生成的条件及稳定存在的范围,知道了金属的电极电位和溶液的pH值,就可以估计出金属是处于稳定状态,还是钝化状态,或者是腐蚀状态,对于研究腐蚀和制定防腐措施具有十分重要的意义。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






