1.腐蚀电池
腐蚀电池概括来说是只能导致材料破坏而不能对外界做有用功的短路原电池。如图14-1所示,把金属铜片和金属锌片分别放入含有CuSO4和ZnSO4电解质溶液当中,用一根导线将锌片和铜片相连,即将原电池的两个电极接通,则电路中就会有电流从电位高的一端流向电位低的一端(Cu极→Zn极)。
在Zn极,电极反应就会按阳极反应方向进行
Zn→Zn2++2e
而在Cu极,电极反应按阴极反应方向进行
Cu2++2e→Cu
故而整个原电池的反应为
Zn+Cu2+→Zn2++Cu(www.daowen.com)
把进行阳极反应(发生氧化反应)的电极叫阳极或负极,把进行阴极反应(发生还原反应)的电极叫阴极或正极,图14-1中展示的是一短路原电池,此时V≈0,不对外提供有用功,只相当于一个进行氧化还原反应的装置。在整个过程中,Zn被氧化成Zn2+,Cu2+被还原为Cu,所以把进行这种腐蚀反应的短路原电池叫做腐蚀电池。总之,作为一个腐蚀电池,必须包括阴极、阳极、电解质溶液和电路4个不可分割的部分。
腐蚀电池的类型多,不同形态的腐蚀电池可形成不同的腐蚀形式,一般说来主要有微观腐蚀电池和宏观腐蚀电池。实际中任何一种金属或合金都不是单一纯净的,总含有一些杂质。当金属与电解质溶液接触时,这些杂质就会和基本金属形成许许多多微小的腐蚀电池,成为腐蚀微电池。金属本身的化学不均匀性是形成腐蚀微电池的重要原因,此外还有金属的组织结构不均匀性、物理状态不均匀性、表面膜不均匀等诱因。
实际生产中常见的宏观腐蚀电池包括电偶腐蚀电池、浓差电池、温差电池等类型。电偶腐蚀实际上是由于异种金属接触,不同金属或合金接触后,当处于同一电解质溶液中时,电位较低的材料成为阳极,不断被腐蚀,电位较高的材料得到保护。工业生产中常采用的牺牲阳极保护阴极的方法就是利用电偶腐蚀的原理来实现的。
2.电解作用
从能量转化的角度来说电解就是电能转变为化学能的过程,也就是在外加电流的作用下,电流通过电解质溶液引起两极上发生化学变化。电解时两电极得失电子发生氧化还原反应,按电流方向判断,向电解液流出电流的金属部分为阳极,发生溶解,从腐蚀角度来看,就是发生了电化学腐蚀,由此可见电解作用也包含于金属电化学腐蚀机理范畴。
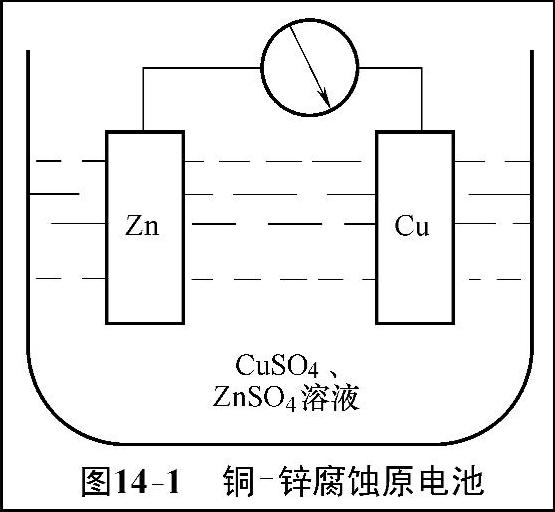
图14-1 铜锌腐蚀原电池
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






