按照国标GB/T 17930—2011中的实验方法来衡量甲醇汽油的腐蚀性,试验结果表明甲醇汽油没有腐蚀性或者说至少不比汽油严重,因为铜片在实验周期后几乎不变色,这就使得人们对甲醇汽油的腐蚀性产生疑问。
那么,甲醇汽油在实际应用中出现的一些现象又怎么解释呢?图11-10是使用甲醇汽油后电动燃油泵解体后部分零件的损坏情况。

图11-10 燃油泵损坏情况

图11-11 腐蚀测试铜片
从图中可以看出,三个零件的铜质部分,严重锈蚀(是腐蚀和磨损的复合结果)。换向器端面已经损坏,可以想象换向器端面先发生锈蚀,然后在电刷的摩擦下,迅速消耗,电路遭到破坏以至无法工作。支撑环锈蚀后导向功能丧失,电枢运转不平稳,最终使得电动燃油泵出现磨损和烧死而损坏。腐蚀也作用于铜导线上,导线强度下降,出现振动后,使导线断裂,燃油泵停止工作。
从上面的分析来看,只能得出一个结论:那就是原来的腐蚀性实验方法不适用于甲醇汽油。为了从根本上说明甲醇汽油的腐蚀性,将不同金属片浸泡到甲醇汽油中三个月,温度不再恒温,而是随着气温变化。发现原来光洁的铜片表面出现轻微彩色,而且燃油的颜色也明显加深,说明有腐蚀物质进入燃油中。在随后的实验中条件不变,只是将空气隔绝,发现铜片的腐蚀要轻得多。通过这个实验主要想求证下面几个疑点,甲醇本身到底对金属尤其是铜有没有腐蚀性,如果没有,那么发生的腐蚀现象到底又是什么原因,是空气的水分和氧气进入甲醇导致腐蚀,还是甲醇出现氧化产生甲酸导致腐蚀的发生,这个氧化的发生和空气是否有关。实验中将事先准备好的四个容器分为两组,一组没有铜片,另一组有铜片。同时各组中有一个是隔绝空气。实验周期后,首先观察试验结果,同时测量甲醇的pH值。实验结果如图11-11所示。
没有密封的铜片发生较严重的腐蚀,而密封的铜片由于表面形成氧化亚铜,从而保护铜免受进一步腐蚀。同时检测了溶剂的pH值,密封溶剂的pH值为8.8,而没有密封的溶剂的pH值为9.4。没有铜片的溶剂的pH值在7.03~7.06之间。那么没有密封的铜片的腐蚀机理又是什么样呢?(https://www.daowen.com)
参照铜导线在水中的腐蚀机理来说明,铜导线在不含氧的水中腐蚀速率是很低的,仅4~10g/(m2·h)的数量级。而当水中溶有游离二氧化碳后,并有溶解氧的情况下,铜的腐蚀速度大大提高。若水的pH值在6.9以下时,则铜的状态是处于腐蚀区,在pH值高于6.9,铜表面的初始Cu2O膜能稳定存在,铜处于被保护或较安全状态。
空气中二氧化碳,常压下在纯水中的溶解度25℃时0.436mg/L,35℃时0.331mg/L,由碳酸水溶液解常数计算,此时溶液pH值约为6.74,铜的状态处于腐蚀区。
铜的腐蚀速度与水中溶氧浓度和水的pH值及电导率(水的纯度)之间的关系如图11-12。含氧量在100~600μg/L时,在pH值小于8的范围内,氧化亚铜Cu2O的溶解度比氧化铜CuO的溶解度低得多,而在pH值8~9时,铜的溶解率很低,基本保持不变。当pH值大于9时,溶解度重新增加。综合分析,铜的腐蚀是一个非常复杂的过程。
图11-11中两个铜片。右边铜试片表面灰黑色,平滑,呈膜状态,表面可见均匀分布0.2~0.5mm的圆点痕迹,但圆点上未见腐蚀产物堆积和腐蚀坑点。对试片表面用KRATOSXSAM800电子能谱仪作XPS分析,表面成分是一价铜和氧,即表面灰黑色膜为Cu2O。用扫描电镜放大2000倍成像,表面形成均匀的氧化亚铜保护膜。经称重测算,指示片平均腐蚀速率0.0024mm/a,由表面状态看,属于铜在水体系中正常的氧腐蚀。左边铜片表面为彩色,也就是铜片发生耗氧腐蚀,产生二价铜离子。
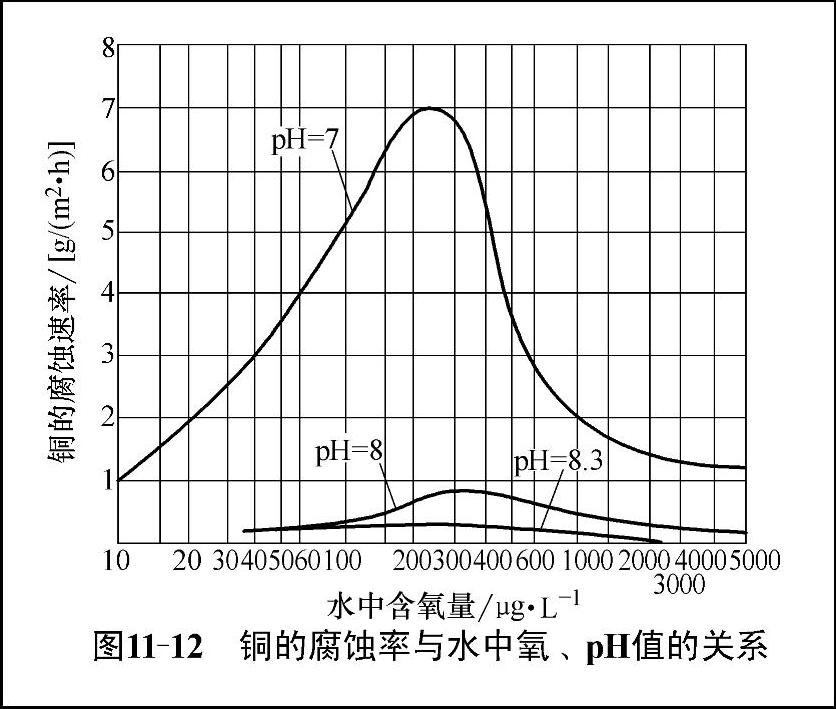
图11-12 铜的腐蚀率与水中氧、pH值的关系
由此可以发现,保证甲醇汽油合理的pH值和防止二氧化碳、水和氧气溶入是保护电动燃油泵避免腐蚀的重要措施之一。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





