1)技术指标
测定范围:5.3μmol/dm3~1.0×103μmol/dm3。
检测下限:5.3μmol/dm3。
精密度:含量低于160.0μmol/dm3时,标准偏差为±2.8μmol/dm3;含量大于或等于550.0μmol/dm3时,标准偏差为±4.0μmol/dm3。
2)方法原理
当水样中加入氯化锰和碱性碘化钾试剂后,生成的氢氧化锰被水中溶解氧氧化生成MnO(OH)2褐色沉淀。加硫酸酸化后,沉淀溶解。再用硫代硫酸钠标准溶液滴定析出的碘,换算溶解氧含量。
3)试剂及其配制
除另有说明外,所用试剂均为分析纯,水为蒸馏水或等效纯水。
(1)氯化锰溶液:c(MnC12)=2.4mol/dm3
称取480.0g氯化锰(MnCI2·4H2O)溶于水中,并稀释至1000cm3。
(2)碱性碘化钾溶液:c(NaOH)=6.4mol/dm3,c(KI)=1.8mol/dm3
称取256.0g氢氧化钠(NaOH)溶解于300.0cm3水中,另称取300.0g碘化钾(KI)溶解于300.0cm3水中,然后将上述两溶液混合,并稀释至1000.0cm3。
(3)硫酸溶液:体积分数为25%
在搅拌和水浴的冷却下,将1体积的浓硫酸(H2SO4,ρ=1.84g/cm3)缓慢地加入于3体积的水中。
(4)硫代硫酸钠溶液:c(Na2S2O3)=1.0×104μmol/dm3
称取25.0g硫代硫酸钠(Na2S2O3·5H2O),用少量水溶解后,稀释至1000.0cm3,加入1.0g无水碳酸钠(Na2CO3),混匀。贮于棕色试剂瓶中,此溶液浓度为0.1mol/dm3。放置15.0d后,用刚煮沸冷却的水稀释成0.01mol/dm3的溶液。保存于棕色瓶中,使用前标定。
(5)碘酸钾标准溶液:c(1/6 KIO3)=1.0×104μmol/dm3
称取3.567g碘酸钾(KIO3,优级纯,预先在120℃温度下烘2.0h,置于硅胶干燥器中冷却至室温),溶于刚煮沸并冷却至室温水中,转移入1000.0cm3量瓶中,稀释至标线,混匀,贮于棕色试剂瓶中。在5℃~6℃低温下保存,有效期三个月。使用时移取10.0cm3,用水稀释至100.0m3,此溶液浓度为1.0×104μmol/dm3。
(6)淀粉-丙三醇(甘油)指示剂
称取3.0g可溶性淀粉[(C6H10O5)n],加入100.0cm3丙三醇[C3H5(OH)3],搅拌并加热至190℃至淀粉完全溶解。此溶液在常温下可保存一年,出现浑浊不影响指示剂的功效。
4)仪器与设备
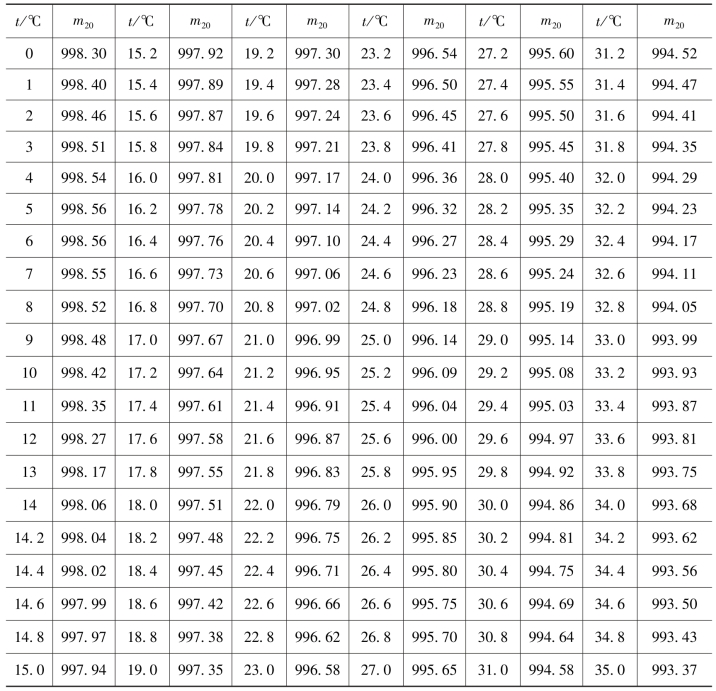
①水样瓶:容积约120.0cm3棕色磨口玻璃瓶,瓶塞为锥形或斜平底形,磨口要严密,每个水样瓶应按下述程序测定容积准确至0.1cm3;将水样瓶装满蒸馏水,塞上瓶塞、擦干,称重。减去干燥的空瓶重量,除以该水温时蒸馏水的密度(表4.4),测得水样瓶容积。将瓶号及相应的水样瓶容积测量结果记录,备查。
表4.4 20℃时容积为1000dm3玻璃容器中的蒸馏水在不同温度时的质量(m20) 单位:g/dm3
②溶解氧滴定管:25.0cm3,分刻度值为0.05cm3。
③电磁搅拌器:转速可调至150r/min~400r/min。
④磁转子(玻璃或聚四氟乙烯包裹):直径约3.0mm~5.0mm,长25.0mm。
⑤定量加液器:1.0cm3,5.0cm3。
⑥移液吸管:15.0cm3。
5)测定步骤
(1)硫代硫酸钠溶液的标定
用移液吸管吸取15.0cm3碘酸钾标准溶液,沿壁注入250.0cm3碘量瓶中,用少量水冲洗瓶内壁,加入0.6g碘化钾,混匀。再加入1.0cm3硫酸溶液,再混匀,盖好瓶塞,在暗处放置2.0min。取下瓶塞,沿壁加入110.0cm3水,放入磁转子,置于电磁搅拌器上,立即开始搅拌并用硫代硫酸钠溶液进行滴定,待试液呈淡黄色时加入3~4滴淀粉指示剂,继续滴至溶液蓝色刚消失。
重复标定至两次滴定管读数相差不超过0.03cm3为止。将滴定管读数记入溶解氧测定记录表中(表4.5),每隔24.0h标定一次。(https://www.daowen.com)
表4.5 溶解氧测定(碘量滴定法)记录表

(2)水样测定
水样固定后,待沉淀物沉降聚集至瓶的下部,便可进行滴定。
将水样瓶上层清液倒出一部分于250.0cm3锥形烧瓶中,立即向沉淀中加入1.0cm3硫酸溶液,塞紧瓶塞,振荡水样瓶至沉淀全部溶解。
将水样瓶内溶液沿壁倾倒入上述锥形烧瓶中,将其置于电磁搅拌器上,立即搅拌,并滴定,待试液呈淡黄色时,加入3~4滴淀粉指示剂,继续滴定至呈淡蓝色。
用锥形烧瓶中的少量试液荡洗原水样瓶,再将其倒入圆锥形烧瓶中,继续滴定至无色。待20s后,如试液不呈淡蓝色,即为终点。将滴定所消耗的硫代硫酸钠溶液体积记录于溶解氧测定记录表中。
(3)试剂空白试验
取100.0cm3海水,加入1.0cm3硫酸溶液,1.0cm3碱性碘化钾溶液,混匀,再加入1.0cm3氯化锰溶液,混合均匀,放置10.0min,加入3~4滴淀粉指示剂,混匀。此时,若溶液呈现淡蓝色,继续用硫代硫酸钠溶液滴定。如硫代硫酸钠用量超出0.1cm3,则应核查碘化钾和氯化锰试剂的可靠性并重新配制试剂。如果硫代硫酸钠用量小于或等于0.1cm3,或加入淀粉指示剂后溶液不呈现淡蓝色,且加入一滴碘酸钾溶液后,溶液立即呈现蓝色,则试剂空白可以忽略不计。
每批新配制试剂应进行一次空白试验。
6)计算
①海水中溶解氧浓度计算见下式:
![]()
式中,c(O)为海水中溶解氧浓度,μmol/dm3;V为滴定样品时消耗的硫代硫酸钠溶液体积,cm3;c为硫代硫酸钠溶液标定浓度,μmol/dm3;V1-V2为实际水样的体积,cm3。其中,V1为水样瓶的容积,cm3,V2为固定水样的固定剂体积,cm3。
②氧饱和度r(O)的计算公式见下式:
![]()
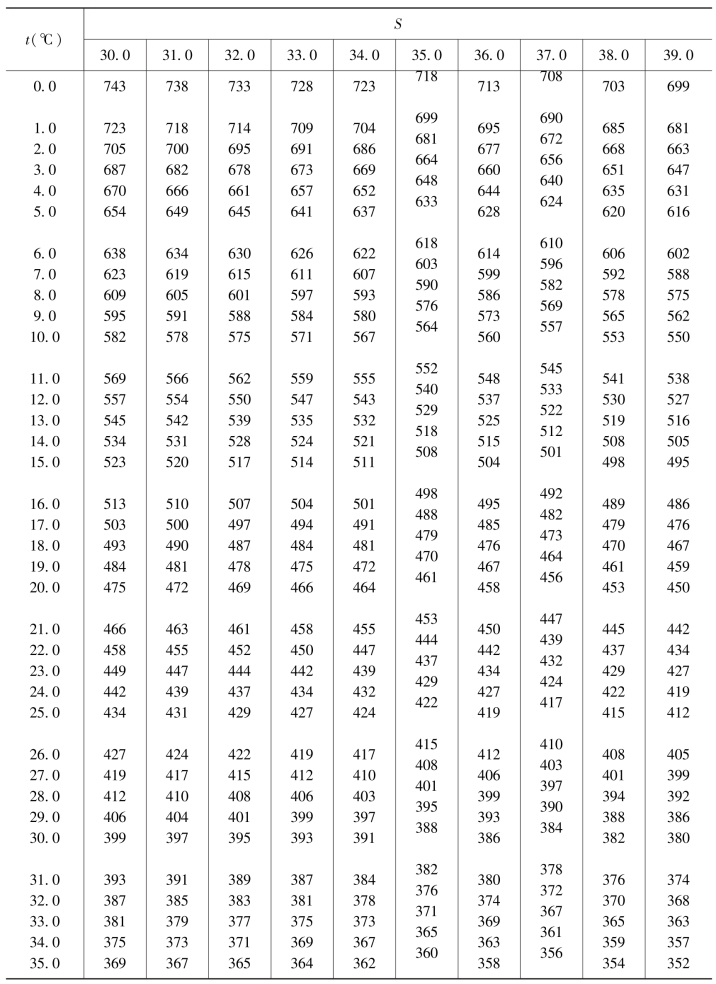
式中,c(O)为测得水样的氧浓度,μmol/dm3;c(O′)为在现场水温、盐度下,氧在海水中的饱和浓度,μmol/dm3(由表4.6查得或由式(4.9)求得)。
③氧在不同水温、盐度的海水中的饱和浓度计算公式见下式:
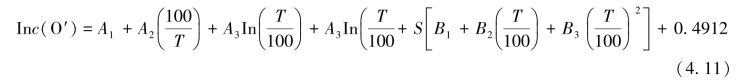
式中,c(O′)为氧在海水中的饱和浓度,μmol/dm3;T为现场的海水热力学温度,开(K);S为现场的海水盐度;A、B为常数,其量值分别为:
A1=173.4292;A2=249.6339;A3=143.3483;A4=-21.8492
B1=-0.033096;B2=0.014259;B3=-0.001700
7)仲裁方法
溶解氧测定(碘量滴定法)为仲裁方法。除本方法外,另有分光光度法。
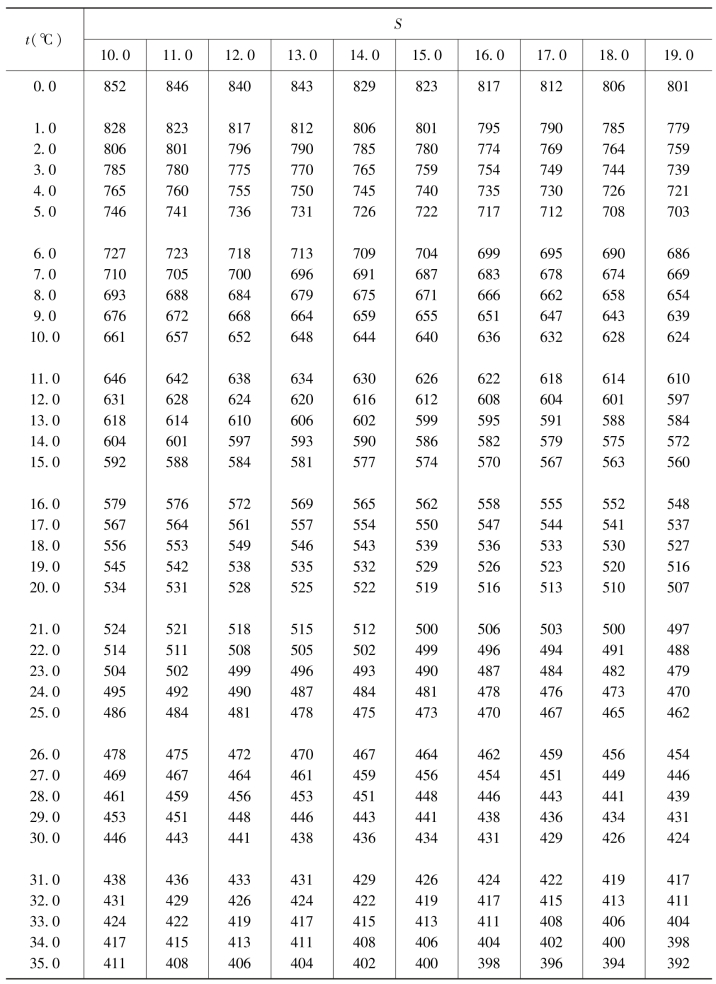
表4.6 空气中氧在不同温度和盐度海水中的饱和浓度 单位:μmol/dm3

续表
续表
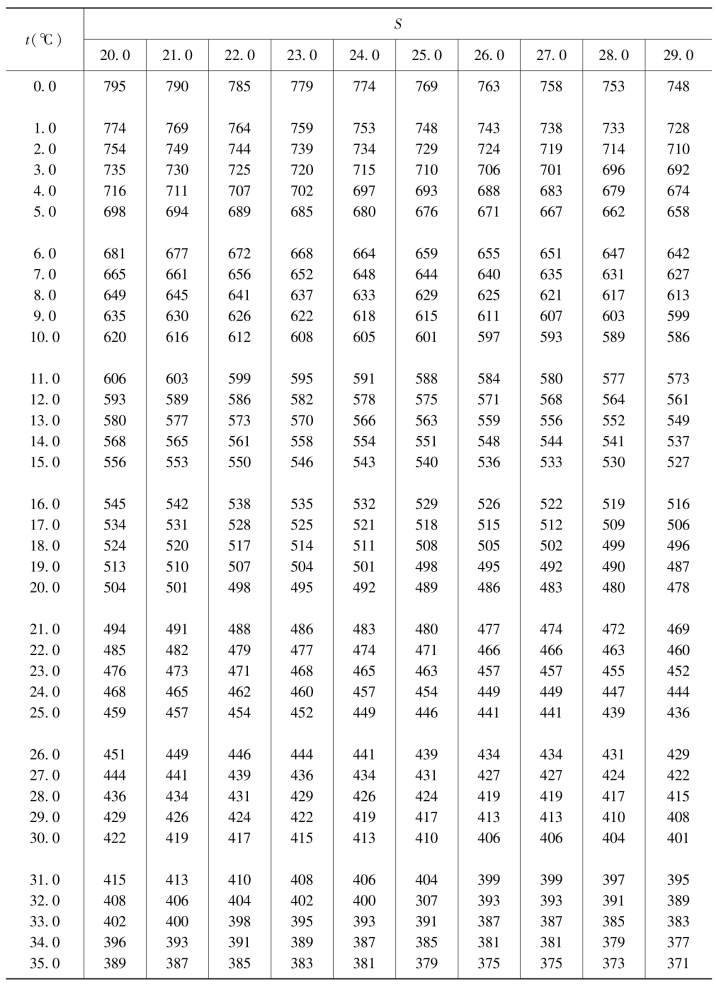
续表
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





