【摘要】:由于在密封的阀控免维护铅酸蓄电池中,具有氧循环的设计,即正极板上析出的氧在负极板上被还原重新生成水而消失,因此析气量很小,不需要补充水。铅酸蓄电池的放电反应为上述过程的逆反应,在此不再赘述。图3-23 铅酸蓄电池反应原理
铅酸蓄电池放电时的电化学反应被称为双硫化反应,正极成流反应为
PbO2+3H++HSO4-+2e-→PbSO4+2H2O (3-13)
负极成流反应为
Pb+HSO4-→PbSO4+2e-+H+ (3-14)
电池总反应
PbSO4+Pb+2H2SO4→2PbSO4+2H2O (3-15)
在充电时,铅酸电池内部发生如下反应
PbSO4-2e-+2H2O→PbO2+2H++H2SO4 (3-16)
正极:

负极:(www.daowen.com)
PbSO4+2e-+2H+→Pb+H2SO4 (3-18)
2H++2e-→H2 (3-19)
其中,式(3-16)和式(3-18)是蓄电池的充电反应,而式(3-17)和式(3-19)则是电解水的副反应,图3-23为铅酸蓄电池反应原理。在充电过程中,可以根据两种反应的激烈程度将充电分为三个阶段:高效阶段、混合阶段和气体析出阶段。
(1)高效阶段 高效阶段的主要反应是PbSO4转换成为Pb和PbO2,充电接受率约为100%。充电接受率是转化为电化学储备的电能与来自充电机输出端电能之比。这一阶段在电池电压达到2.39V/单元(取决于温度和充电率)时结束。
(2)混合阶段 水的电解反应与主反应同时发生,充电接受率逐渐下降。当电池电压和酸液的浓度不再上升时,电池单元被认为是充满了。
(3)气体析出阶段 电池已充满,电池中进行水的电解和自放电反应。由于在密封的阀控免维护铅酸蓄电池中,具有氧循环的设计,即正极板上析出的氧在负极板上被还原重新生成水而消失,因此析气量很小,不需要补充水。
铅酸蓄电池的放电反应为上述过程的逆反应,在此不再赘述。
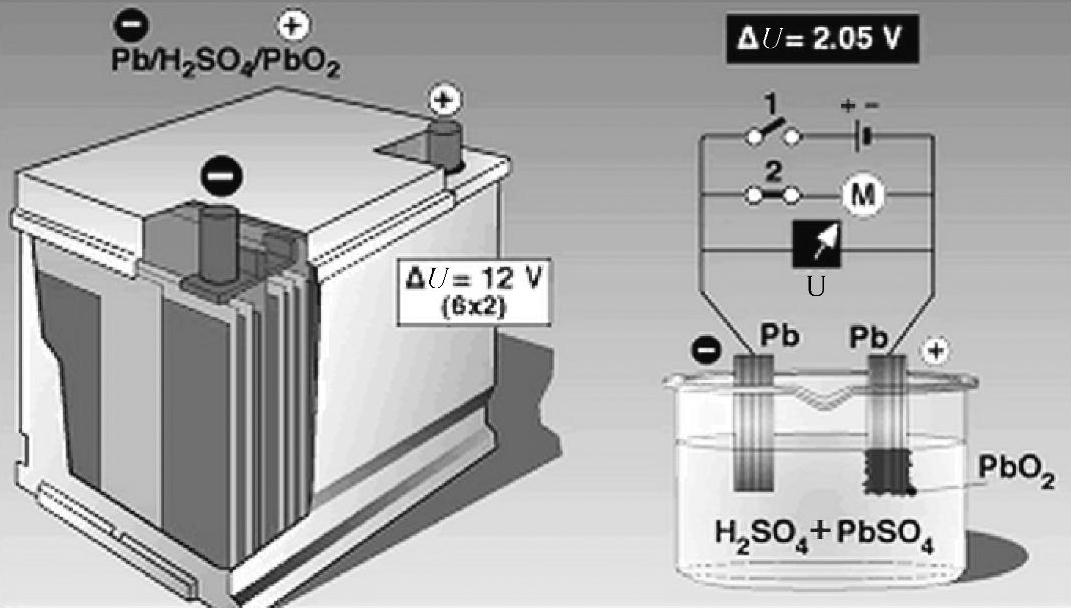
图3-23 铅酸蓄电池反应原理
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
有关手把手教您学修电动汽车的文章





