排水管道内的污水以及沉积物,会释放各种臭气物质进入管道上部空间与其中的空气混合,在一定水力条件下,通过排水系统构筑物缝隙或其他通道排入周边大气,影响周边居民生活。臭气的主要成分有硫化氢(H2S)、甲硫醇(CH4S)、甲硫醚(C2H6S)、氨气(NH3)、二甲二硫(C2H6S2)、二硫化碳(CS2)、苯乙烯(C8H8)、三甲胺(C3H9N)等,其中主要致臭物质为硫化物、氨气等。硫化氢不但对周边环境产生影响,在一定条件下还会被氧化成为硫酸,腐蚀管道内壁,如图4-47所示。
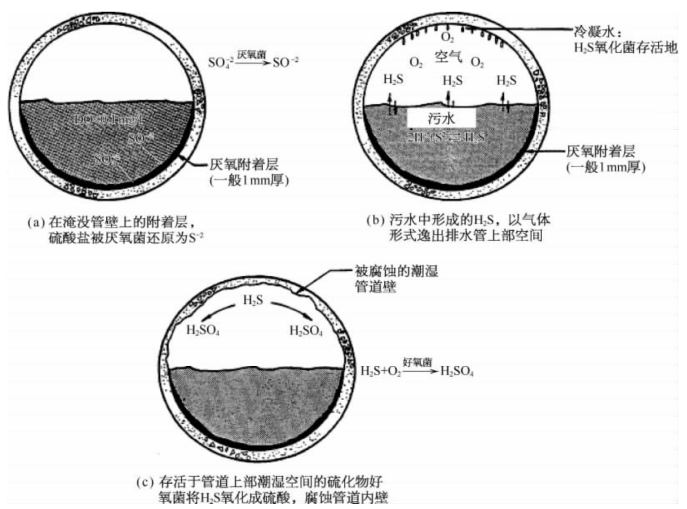
图4-47 污水管道内硫酸生成机理图
4.6.1.1 硫化氢对管道内壁的腐蚀机理
(1)生活污水、工业废水以及地表径流中含有硫酸盐。排水管道与污水接触,在水下管道壁形成一层黏滞层,黏滞层内为厌氧环境。溶于水的硫酸根离子(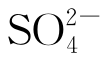 )在黏滞层内厌氧菌的作用下,被还原为二价硫离子(S2-)。
)在黏滞层内厌氧菌的作用下,被还原为二价硫离子(S2-)。
(2)硫离子(S2-)进入污水,形成硫化氢(H2S),H2S以气体的形式溢入管道上部空气,形成硫化氢气体。在管道上部潮湿环境下,形成H2S氧化菌的生存环境,滋生产硫酸杆菌的生长。
(3)在产硫酸杆菌的作用下,H2S气体和管道上部空气内的O2结合,生成H2SO4。
排水管道内特殊的环境条件下生成的硫酸,对暴露的管道内壁,包括混凝土结构、钢铁结构等都会产生强烈腐蚀,导致排水管道使用寿命减短。因此,为了抑制大型排水管道内硫酸对管道的腐蚀,从20世纪90年代开始,研究人员进行了大量研究工作,建议排水管道防腐的途径有两个:①污水中添加过氧化氢、氯化铁等氧化剂,抑制H2S气体的产生;②设计完善的通风、除臭系统,不但保护管道不被腐蚀,同时净化污水管道排除的臭气。
4.6.1.2 硫化氢的产生机理和影响因素
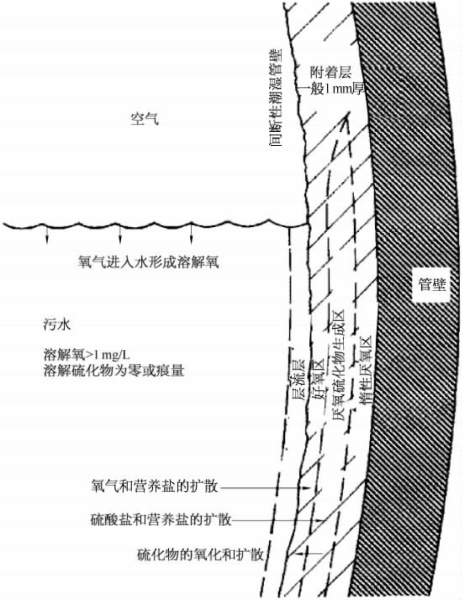
在废水收集和处理系统中,硫化氢产生的主要原因是:厌氧条件下硫酸盐发生还原反应,生成硫化氢,如图4-48所示。其反应过程分为两个阶段:
阶段1
![]()
阶段2
![]()
(1)温度对阶段1的影响
在大都市地区的降雨过程中时常伴随着硫酸盐的出现,使得硫酸盐成为了自然水体中最为常见的阴离子之一。对上述阶段1反应中的其他硫的来源还有人类排泄物中存在的有机硫化合物,将会形成阶段1中的反应物。
在深隧系统内部水面以下,有机物将在壁面形成一层薄薄的黏液层,其中生存着各种活细菌。由图4-48所示,该黏液层的第一层内存在好氧菌,它可将水中的溶解氧分解生成二氧化碳和水;第二层内存在厌氧菌,其使用硫酸盐和有机物质产生硫化物;它们的生化反应方程式见上文中的阶段1。但是需要说明的是,若黏液层内溶解氧充足,厌氧区内的硫化物会被好氧区内的好氧菌利用、氧化为硫酸盐。只有当氧气不存在或很少时,厌氧区内的生化反应才足够活跃以使得硫化物产物释放至污水中。因此,针对阶段1,溶解氧的含量是主要控制因素。
温度对水中溶解氧的含量影响很大,进而影响硫化物的产生量。具体原因如下:
①随着水温升高,氧气在水中的溶解度降低。因此,水温升高,溶解氧随之降低,而硫化物浓度升高。
 (https://www.daowen.com)
(https://www.daowen.com)
图4-48 排水管道壁硫化物转化机理图
②研究表明,硫酸盐还原菌的生物活性随温度升高而增强。参考相关文献、资料均指出:当水温不高于30℃时,水温每升高1℃,硫化物的产生率可提高7%。在水温不高于30℃的条件下,这相当于每升温10℃,反应速率便加快一倍。
由上可知,随水温升高,阶段1的反应速率增加,则中间硫化物产物和最终产物硫化氢的数量也会增多。
(2)温度对阶段2的影响
阶段1产生的硫化物在水中以三种不同的化学平衡的形式存在:硫化物离子(S2-)、氢硫化物或二硫化物离子(HS-)和硫化氢水溶液[H2S(aq)]。其中,只有硫化氢水溶液可以生成硫化氢气体[H2S(gas)]逸出水面,导致恶臭和管道腐蚀的问题。此外,溶液的pH 是决定硫化氢水溶液占硫化物总量比例的最重要因素。溶液pH 越低,硫化氢水溶液含量越高。依据亨利定律和水流的湍流程度,可推算得到以H2S(gas)的形式逸出水的H2S(aq)的量。
由于亨利定律有赖温性,温度对H2S(气体)的释放量的影响用该值表征,H2S的无单位亨利定律常数由下式给出:
![]()
式中 H——H2S在亨利定律中的常数(无量纲);
T——污水的温度(℃)。
根据溶液pH 确定硫化物浓度,进而确定H2S(aq)浓度。这样可以使用亨利定律常数计算平衡H2S(gas)浓度如下:
![]()
由公式可知,温度越高,亨利定律常数越大;反向作用于H2S的浓度计算时,其平衡气相的H2S浓度越高。这与大多数气体的溶解度随温度升高而降低的事实一致。因此,可以得出结论,在阶段2的反应中,水温增加有利于H2S向外界大气的释放。
(3)硫化氢平衡浓度的估算
某工程项目采样硫化物浓度最高值为0.15mg/L,实测pH 为7.0。依据此pH,作为H2S(aq)存在的硫化物的比例为约50%,浓度为0.075mg/L。基于这些输入参数,表4-3列出了各种温度下的亨利定律和H2S(gas)平衡浓度。
表4-3 亨利定律常数和H2S(gas)平衡浓度
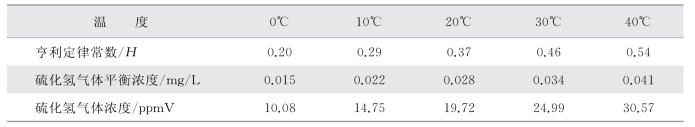
计算每10℃温度变化H2S的平衡浓度变化百分比,结果如图4-49所示。
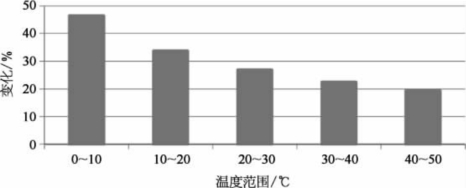
图4-49 随温度升高的H2S浓度变化率
与预期一致,H2S浓度的百分比变化随温度升高逐渐下降,并在30℃后开始稳定。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






