溶解是溶剂(包括水)有选择或无选择地溶解矿物中的可溶性物质的过程,盐岩的溶解是无选择性的溶解。盐类矿物储层溶腔建造过程中的溶剂为水,由水的化学分子式H 2 O可知,H 2 O是由1个带负电的氧离子和2个带正电的氢离子组成的。在分子结构上,由于氢和氧的分布不对称性,在接近氧离子一端形成负极,接近氢离子一端形成正极,水分子为一个偶极分子。当水与盐类矿物接触时,组成结晶格架的离子被水分子带有相反电荷的一端所吸引;当水分子对离子的引力足以克服结晶格架中离子间的引力时,盐类矿物结晶格架遭到破坏,离子进入水中。这就是盐类矿物被水溶解的物理-化学过程。
为了研究盐类矿物的致密性,T.Dale[1]对原始的盐岩做渗透试验,结果显示渗透率非常低,渗透率k为1×10-21 m2;在王清明的盐类矿床水溶开采研究中[2],定义渗透率k小于10-17 m2的岩石材料为不渗透岩石,并发现盐岩的溶解作用主要发生在矿物的表层,矿物由表及里逐渐溶解。
在初始溶解阶段,溶液的含盐浓度极低,矿物溶解速度快。随时间的延续、溶解的进行,矿物表层附近的溶液浓度逐渐增大,溶液溶解和接收盐类物质的能力逐渐减弱,溶解速度逐渐变慢,而远离矿物表面的溶液浓度依然较低。这样,靠近矿物表层与远离矿物区域的溶液之间就存在一定的浓度差。根据溶质扩散原理,这一浓度差会促使高浓度卤水区域的盐类物质向低浓度方向扩散,从而降低矿物表层附近区域溶液的浓度,增强其继续溶解的能力,直至整个溶液达到饱和,扩散作用才停止进行,这就是盐类矿物的溶质扩散[3 7]。
因此,盐类矿物溶解过程的推动力是溶液的浓度差,但实际上溶解过程是双向的,即溶解和结晶过程同时进行。当溶剂作用到矿物表面时,由于溶质分子本身的运动和溶剂分子对它的吸引,溶质离开固体表面,扩散到溶液中去,同时溶液中的溶质在运动过程中遇到没有溶解的矿物时,又重新从溶液中结晶到矿物表面。也就是说,溶解到溶剂中的溶质分子或离子,在其运动过程中遇到尚未溶解的溶质,有可能被吸引住,重新回到矿物表面上来。边界上的溶解示意如图2-1所示。
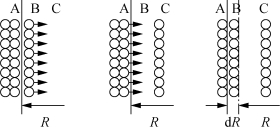
图2-1 盐类矿物边界溶解示意[8]
图中,A为盐岩表面,B为边界的底层,C为边界的扩散区域,溶解过程可以形象地解释如下:(https://www.daowen.com)
(1)在溶解的边界区域内,边界底层的盐岩分子在由于浓度差造成的扩散梯度影响下扩散进入扩散区域,致使底层的浓度降低,低于饱和浓度。
(2)盐岩固体表面的盐分子溶解,进入边界的底层,维持浓度的平衡,使底层溶液浓度达到新的动态平衡。
(3)对于溶腔来说,盐岩的溶解会使溶腔半径增大d R,总的半径变为R+d R,同时溶液在底层的溶腔表面和扩散区域达到新的动态平衡。
显然,溶解刚开始时,溶液中矿物的浓度低,溶解速度大于结晶速度,因此表现出来的似乎只是矿物的溶解。随着溶解过程的进行,溶液中矿物的离子越来越多,浓度越来越大,结晶速度随之增大。当达到一定量时,即溶液中单位时间内溶解的离子数量和结晶的离子数量相等时,溶液中就建立了溶解和结晶的动态平衡:
![]()
此时溶液达到了饱和,该溶液叫作饱和溶液。
盐类矿物在溶解过程中还伴随着热动力现象,既有热量的吸收又有热量的放出。溶解过程中,盐类矿物晶格破坏并在溶液中扩散的过程就是物理过程,本过程同时吸收热量;溶质和水分子结合生成水化物的过程是化学过程,本过程同时放出热量。例如硫酸钠盐岩的溶解过程吸、放热现象比较明显。因此,盐类矿物的溶解是一个物理-化学过程。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








