14.2.1 定性综合实验
试题精编
1.(2020·嘉定·二模)化学实验室里,同学们准备研究氢氧化钠能与二氧化碳反应的化学性质。
完成下列填空。
(1)在配制NaOH溶液时,看到盛有NaOH固体的试剂瓶上标注着“NaOH含量不少于96.0%”,便对该瓶试剂成分产生了质疑。
【提出问题】氢氧化钠中含有什么杂质?
【查阅资料】工业上制取NaOH的反应原理为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
【提出猜想】
甲同学认为杂质只有氯化钠;
乙同学认为杂质还可能含有碳酸钠,原因为____________________________________________(用化学方程式表示)。
【设计实验】取样溶于水,并分成两份。
步骤一:向一份溶液中滴加酚酞试液,溶液变_________________色。
步骤二:向另一份溶液中滴加过量稀硝酸。
步骤三:向步骤二所得溶液中继续滴加_________溶液,发现有白色沉淀产生。
【实验结论】乙同学的猜想正确。
请分析:
Ⅰ.上述实验中步骤_________(填编号)是没有必要进行的。
Ⅱ.步骤二所得溶液中的溶质有__________________________。
(2)同学们在配制好的氢氧化钠溶液中通入CO2气体,没有明显现象,于是设计了如图所示实验证明反应的发生。(不考虑氢氧化钠中的极少量杂质)
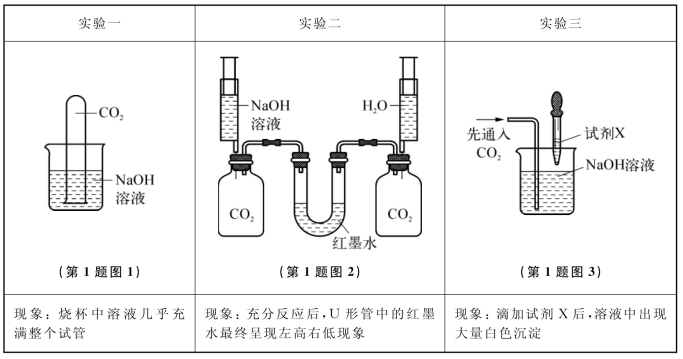
Ⅰ.实验三中加入的试剂X是_____________(任写一种符合要求的试剂)。
Ⅱ.实验一、二在设计思想上是一致的,都是通过验证反应物的消耗才能观察到明显现象,但有同学对实验一提出了质疑,他认为这个实验不足以证明CO2与NaOH发生了化学反应,其理由是_________________________________________。
Ⅲ.查阅资料:室温下,氢氧化钠易溶于酒精,而碳酸钠难溶于酒精。据此,同学们设计了实验四。

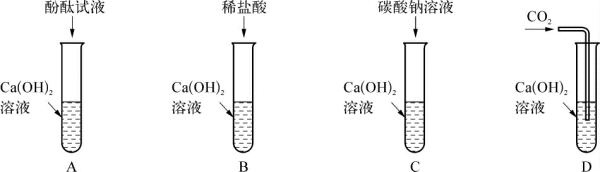
2.(2020·静安·二模)甲、乙两组同学为探究氢氧化钙的化学性质,分别做了如图所示的相同的四个实验。
(第2题图)
完成下列填空。
(1)上述实验中,能发生反应但无明显现象的化学方程式为____________________________。
(2)实验结束后,甲、乙两组同学分别将本组A、B、C、D四支试管中的物质各倒入一个洁净的大烧杯中,充分反应后静置,发现:
甲组烧杯底部有白色沉淀,上层清液为红色,则下列说法错误的是_________(填编号)。
A.沉淀是碳酸钙 B.清液中一定含有氢氧化钠 C.清液中一定没有氯化氢
乙组烧杯底部有白色沉淀,上层清液为无色,则上层清液中一定含有的溶质是________,可能含有的溶质是_____________。
3.(2020·虹口·二模)某硝酸钠样品中可能含有氯化钠、碳酸钠、硫酸钠、氢氧化钠中的一种或几种,为检验其成分,某小组进行了如图所示实验(硝酸钡溶液呈中性,硫酸银微溶于水)。
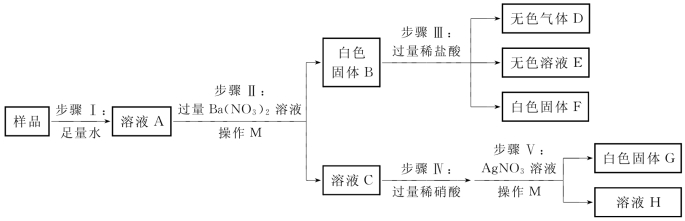
(第3题图)
完成下列填空。
(1)无色气体D是_________,白色固体F是_________,操作M是_________。
(2)步骤Ⅴ中发生反应的化学方程式是________________________________。
(3)步骤Ⅱ加入硝酸钡溶液时需过量,“过量”对步骤Ⅴ目的达成的作用是_______________________________________。
(4)上述实验不能确定样品中是否含有氢氧化钠,改进上述实验方案加以证明。
4.(2020·崇明·二模)某白色固体由硫酸钡、碳酸钙、碳酸钠、氢氧化钙中的三种物质组成。为确定其成分,某同学设计并完成如图实验。
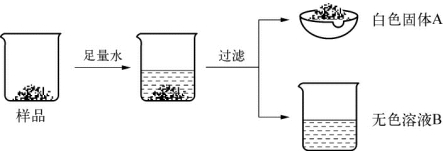
(第4题图)
完成下列填空。
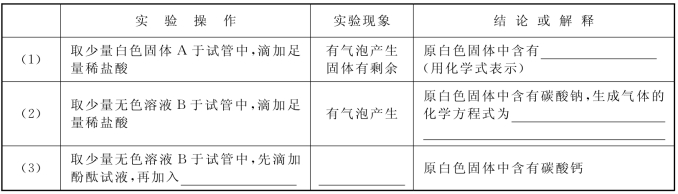
5.(2020·金山·二模)废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。化学兴趣小组为回收其中的铜,设计并进行了如图所示实验。已知:Cu+H2O2+H2SO4 CuSO4+2H2O;不考虑金、银发生类似反应。
CuSO4+2H2O;不考虑金、银发生类似反应。
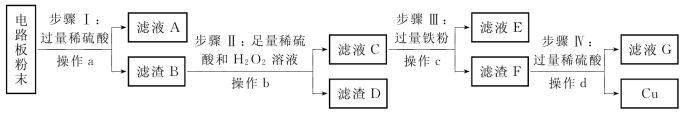
(第5题图)
完成下列填空。
(1)将电路板粉碎成粉末的目的是___________________________________。
(2)滤液A中的溶质除硫酸外,还有__________________________。
(3)步骤Ⅱ中的实验现象:固体部分溶解,____________________________。
(4)上述步骤____________________(填编号)所包含的反应体现铁的活动性比铜强。
(5)步骤Ⅳ中反应的化学方程式是____________________________________________;判断步骤Ⅳ中加入的稀硫酸过量的方法是________________________。
同类题汇总
1-1.(2020·松江·二模)取久置氢氧化钠固体进行如下实验,可以探究出其变质程度,下列说法正确的是( )。
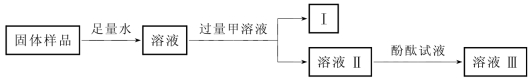
(第1-1题图)
A.甲溶液可能是氢氧化钙溶液 B.物质Ⅰ可能是二氧化碳
C.溶液Ⅱ的溶质可能含甲物质 D.滴加酚酞后,溶液Ⅲ可能不变色
1-2.(2020·金山·二模)化学课堂上,同学们在老师的指导下进行探究实验。探究一瓶忘记盖瓶塞的氢氧化钠溶液中溶质的成分。
【查阅资料】氯化钠溶液都呈中性。
【提出猜想】
猜想1:溶质是氢氧化钠;猜想2:溶质是_________________;猜想3:溶质是碳酸钠。
【设计实验】

【交流讨论】
老师问:“若向少量样品中,加入足量的稀盐酸,如果有气泡产生,猜想3一定成立吗?”同学们交流讨论后,一致认为猜想3不一定成立,原因是_____________________________________________________。
1-3.(2020·普陀·二模)过氧化钠(化学式为Na2O2)可作为供氧剂。兴趣小组同学查阅资料发现过氧化钠有如下性质。
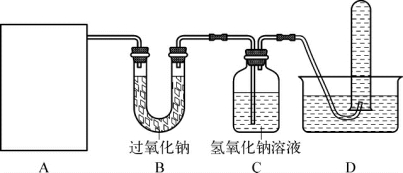
(第1-3题图)
a.与二氧化碳反应生成碳酸钠和氧气;b.和水反应生成氢氧化钠和氧气。
实验目的:验证过氧化钠能与二氧化碳反应,并检验生成的碳酸钠和氧气。兴趣小组用如图所示装置进行实验,其中A处为CO2发生装置。
完成下列填空。
(1)B处过氧化钠与二氧化碳反应的化学方程式为_________________________________。
(2)D中收集氧气的方法称为_________________,检验试管中是氧气的方法是_______________________________________。
(3)有同学认为应增加一个装置使整套实验装置更符合实验目的。请你阐述需要增加的实验装置的作用是_______________,以及添加的位置是___________________。
(4)若要检验产物碳酸钠,取B中反应后样品进行实验,请完成下表中空白处的实验方法。

1-4.(2020·浦东·二模)利用物质的性质能帮助我们开展科学探究。
完成下列填空。
【认识物质】
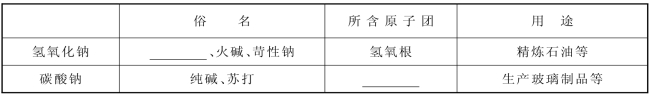
【定性检测】
为检测久置空气中的氢氧化钠是否变质,设计并进行了如图所示的实验:
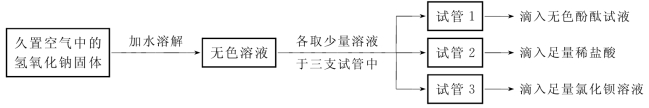
(第1-4题图)
(1)试管1中观察到的现象是__________________________。
(2)试管2中观察到产生气泡,反应的化学方程式为_______________________________。
(3)试管3中观察到产生白色沉淀。
(4)能达到实验目的的是试管_________(填“1”“2”或“3”)中的实验。
(5)若要判断氢氧化钠是部分变质还是全部变质,请你选择上述实验后三支试管中的液体继续实验,并完成下表。

2-1.(2020·长宁·二模)为探究碱的性质,进行如图所示实验。
完成下列填空。
(1)如图1所示,加入一定量的盐酸后,溶液红色褪去,反应过程中溶液温度_________(填“升高”或“降低”),反应的化学方程式为____________________________________。
(2)如图2所示,在NaOH溶液中通入CO2,然后滴加氯化钡溶液(呈中性),如图3所示。有白色沉淀产生。说明NaOH与CO2发生了反应,则乙中反应的化学方程式为__________________________,丙中反应的化学方程式为________________________________________。
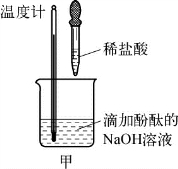
(第2-1题图1)
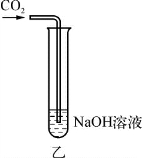
(第2-1题图2)

(第2-1题图3)
(3)实验结束后废液处理。实验结束后将试管丙内所有物质全部倒入一大烧杯中,再将甲烧杯所得溶液缓慢加入,全部加入充分搅拌后测得溶液pH为3。
在将甲烧杯所得溶液缓慢加入的过程中,大烧杯内可观察到的现象是______________________________。最终大烧杯中除了酚酞外,还含有的溶质是_________________。最后,调节pH接近7,达到排放标准。
2-2.(2020·青浦·二模)为研究碳酸钠、氢氧化钙、盐酸的化学性质,进行如图所示实验。
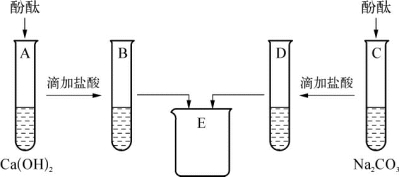
(第2-2题图)
完成下列填空。
(1)A、C中酚酞均变_________色,证明Na2CO3和Ca(OH)2溶液呈碱性。
(2)试管B、D内的物质在烧杯E中混合产生白色沉淀,白色沉淀的化学式为_________,由此能否说明B中有反应物剩余?请你判断及说明理由:____________________________________________________,E中的溶质除酚酞外,一定含有的是_____________(填化学式),可能含有的是___________________________________(填化学式)。
2-3.(2020·金山·二模)化学课堂上,同学们在老师的指导下进行了分组实验。
完成下列填空。
【查阅资料】氯化钙溶液、氯化钠溶液都呈中性。
第Ⅰ组:探究酸和碱的反应。
向试管中加入少量的氢氧化钙溶液,并滴入几滴无色酚酞溶液,充分振荡后,再逐滴滴入稀盐酸,并用玻璃棒不断搅拌,观察到溶液由红色变为无色,测得溶液的pH<7。
第Ⅱ组:为了探究一瓶忘记盖瓶塞的氢氧化钠溶液中溶质的成分。
取少量样品于试管中,向其中加入适量的氯化钡溶液,充分反应后,过滤,向滤液中滴加几滴无色酚酞溶液,产生白色沉淀,无色溶液。
实验结束后,同学们将两组实验后的废液倒入同一个废液缸中进行集中处理。若使废液中只含有一种溶质氯化钠(酚酞除外)则需向废液中加入__________________________。
3-1.(2020·宝山·二模)化学兴趣小组同学,在实验后欲对无色澄清的废液进行检验并回收利用。已知该无色废液中可能含有硫酸、盐酸、氯化镁、氯化钡中的一种或几种,他们的检验和回收流程如图所示。
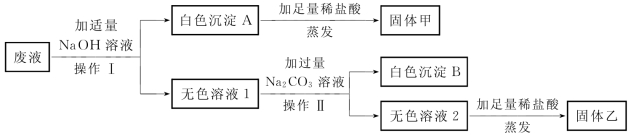
(第3-1题图)
完成下列填空。
(1)操作Ⅰ、操作Ⅱ的名称是_________。
(2)生成白色沉淀A的基本反应类型是_________________。
(3)无色溶液2中加入足量稀盐酸的现象为_________________。
(4)由实验可知,废液中一定含有的溶质是_________________,用化学方程式解释一定不存在的物质的原因_________________________________________________________。
3-2.(2020·松江·二模)某白色固体含有硫酸钠、氢氧化钠、碳酸钠、硝酸钡中的一种或几种,取少量白色固体进行如图所示实验(已知:硫酸钠、硝酸钠、硝酸钡的水溶液均呈中性)。
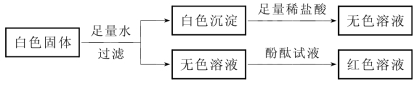
(第3-2题图)
对该白色固体的分析错误的是( )。
A.一定是三种物质 B.一定含硝酸钡
C.可能是三种物质 D.可能是两种物质
4-1.(2020·杨浦·二模)有一包白色固体样品,可能含有NaOH、Na2CO3、K2SO4、NaCl中的一种或几种,为确定其组成,进行如图所示实验。
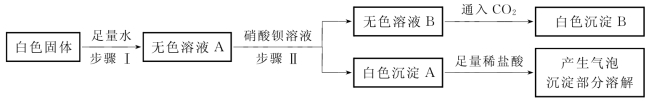
(第4-1题图)
完成下列填空。
(1)步骤Ⅱ中发生的化学反应方程式为___________________________________________(写一个即可)。
(2)无色溶液B中的溶质一定有_________________。
(3)分析上述实验过程,仍无法确定的物质是_________________。
(4)若要进一步确定样品的组成,还需进行的实验操作是________________________________________________________________________________________________________。
4-2.(2020·黄浦·二模)实验室某种废液中含有碳酸钠、氢氧化钠、硫酸铜、盐酸中的一种或两种溶质。为确定其组成设计并进行如图所示实验。
实验:
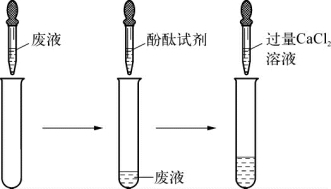
(第4-2题图)
![]() (https://www.daowen.com)
(https://www.daowen.com)
结论:废液中一定含有碳酸钠、氢氧化钠。
分析:废液中一定没有的硫酸铜原因是___________________________________________。
用一个化学方程式说明溶液中一定没有盐酸,该化学方程式为__________________________________________。
5-1.(2020·徐汇·二模)利用废旧电池铜帽(含Cu、Zn)提取Cu,并得到ZnSO4溶液。主要流程如图所示。
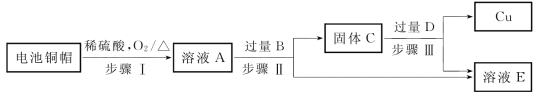
(第5-1题图)
完成下列填空。
(1)步骤Ⅱ、Ⅲ中的分离操作名称是_________。
(2)步骤Ⅱ中加入的B物质为_________,过量的目的是_____________________________。
(3)溶液E中肯定有的溶质的化学式为_________________。
5-2.(2020·松江·二模)从ZnSO4、CuSO4和FeSO4的混合液中回收金属铜,设计了如图所示实验方案。
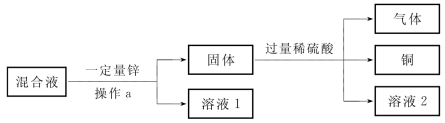
(第5-2题图)
完成下列填空。
(1)操作a的名称是_________,加入锌后,发生反应的一个化学方程式为___________________________________________,该反应体现了铜的金属活动性比锌_________(填“强”或“弱”)。
(2)操作a后的固体中一定有的物质是_________,生成气体的化学式是_________。
14.2.2 定量综合实验
试题精编
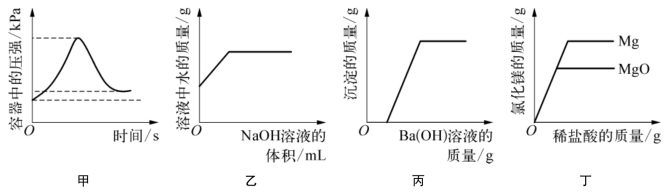
1.(2020·虹口·二模)图示所表示的各实验中相关量的变化关系,正确的是( )。
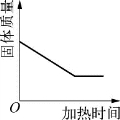
A.高温煅烧石灰石(杂质不反应)
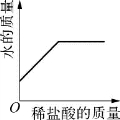
B.氢氧化钠溶液中滴加稀盐酸
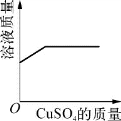
C.接近饱和的硫酸铜溶液中加入硫酸铜粉末
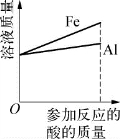
D.等质量、等浓度的稀盐酸中分别放入足量的铁片和铝片
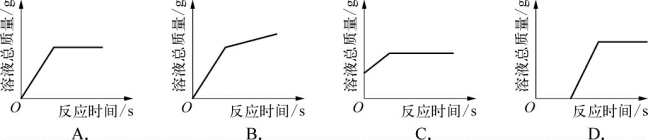
2.(2020·崇明·二模)将稀盐酸逐渐加到盛有氧化铜的容器中,容器中溶液总质量随时间变化曲线正确的是( )。
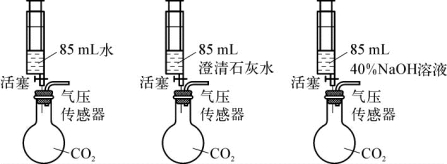
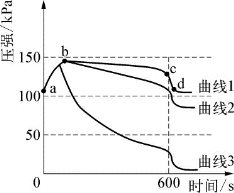
3.(2020·杨浦·二模)实验室制取二氧化碳并验证其性质。实验室用3个250mL的烧瓶收集满CO2进行实验。如图1所示,同时迅速将注射器内液体全部注入各自烧瓶中,关闭活塞;一段时间后,同时振荡三个烧瓶。得到如图2所示的烧瓶内压强与时间的关系曲线图。
完成下列填空。
(1)曲线1中导致cd段气压快速变小的操作是____________________。
(第3题图1)
(第3题图2)
(2)曲线2中发生反应的化学方程式为_______________________________________。
(3)比较曲线2与曲线3的差异,说明原因:__________________________________________________________________________________________________________________________。
(4)根据如图2所示,可以得出的结论是_________(填编号)。
A.1体积水中溶解CO2的量小于1体积 B.CO2能与水发生反应
C.CO2能与NaOH溶液发生反应 D.检验CO2用饱和澄清石灰水较合适
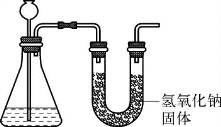
4.(2020·松江·二模)为测定石灰石与稀盐酸反应产生二氧化碳的质量(假设二氧化碳已完全放出,忽略空气中物质的影响),设计如图1所示装置。
完成下列填空。
(1)产生二氧化碳的质量_________(填“大于”“小于”或“等于”)氢氧化钠固体增加的质量。
(2)对锥形瓶中反应后的剩余溶液成分进行探究(杂质不溶于水且不参加反应),剩余溶液中一定有的溶质是_________。
(第4题图1)
(第4题图2)
(3)把剩余溶液分成两份,分别置于两个试管中进行实验。
实验一:往一个试管中滴加硝酸银溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解。
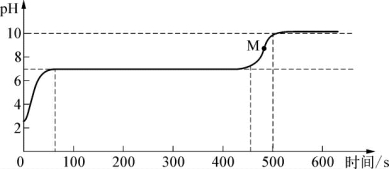
实验二:往另一个试管中逐滴滴入碳酸钠溶液,并用pH传感器连续监测试管内溶液的pH,得如图2所示。
根据实验_________(填编号)可知,剩余溶液中还有盐酸。
(4)曲线上M点溶液的溶质成分是_________。
5.(2020·闵行·二模)“垃圾是放错位置的资源”,废旧金属的回收利用可节约资源、减少污染。为测定某废铜屑(含铜、铜锈、氧化锌)中铜元素的含量,以便合理回收金属,化学小组取一定质量的样品,分别用如下方法获取相关数据。
完成下列填空。
【查阅资料】铜锈的成分为碱式碳酸铜[Cu2(OH)2CO3];
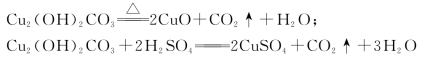
【设计与实验】
![]()
(第5题图1)
(第5题图2)
(第5题图3)
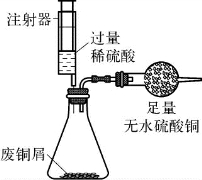
(第5题图4)
【实验分析】
(1)方法一中,在装置A中添加用于通入H2的玻璃导管。加足量稀硫酸反应的化学方程式是___________________________________________________________________________。
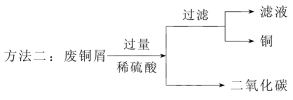
(2)方法二:装置B中“足量无水硫酸铜”的作用是____________________。过滤后滤液中的溶质是___________________________________。此步骤还可证明锌的金属活动性比铜强,理由是___________________________________。实验中,待锥形瓶内的反应结束后,可用注射器向瓶内多次来回推入空气,其目的是__________________。为测定废铜屑中铜元素的含量,结合图中装置需要称量并记录的数据有___________________________、_________________。
【实验反思】
(3)通过分析,与方法一相比较,方法二的一条不足之处是_____________________________。
同类题汇总
1-1.(2020·杨浦·二模)下列四个图像能正确反映对应变化关系的是( )。
(第1-1题图)
A.甲——在密闭容器中用红磷测定空气中氧气的含量
B.乙——常温下向一定量的稀硫酸中滴加氢氧化钠溶液
C.丙——向盐酸和硫酸钠的混合溶液中滴加氢氧化钡溶液
D.丁——向等质量的镁和氧化镁固体中,分别加入质量分数相同的稀盐酸
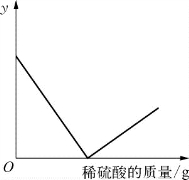
2-1.(2020·奉贤·二模)向氢氧化钡溶液中逐滴加入稀硫酸,某个量y随稀硫酸的加入的变化情况如图所示,则y表示( )。
A.溶液的pH B.沉淀的质量
C.溶质的质量 D.氢氧化钡的质量
(第2-1题图)
(第2-2题图)
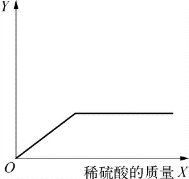
2-2.(2020·徐汇·二模)向一定量的铁粉与铜粉的混合物中逐滴加入稀硫酸至过量,如图是反应过程中某种物质的质量Y随加入稀硫酸质量X变化的关系,则Y可能表示( )。
A.铜粉的质量
B.生成硫酸铜的质量
C.溶液的总质量
D.生成硫酸亚铁的质量
3-1.(2020·青浦·二模)实验小组用传感器研究等量水或NaOH溶液分别吸收CO2的效果,实验装置及测定结果如图所示。下列说法不正确的是( )。
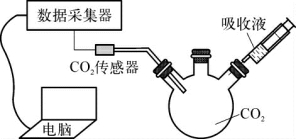
(第3-1题图1)
(第3-1题图2)
A.曲线Ⅰ是CO2溶解和CO2与水反应的综合结果
B.对比曲线Ⅰ和Ⅱ,可说明CO2能与NaOH反应
C.NaOH溶液吸收CO2的效果比水好
D.若选用等质量饱和石灰水进行实验,其曲线在曲线Ⅰ上方
3-2.(2020·闵行·二模)如图所示实验中(装置气密性好),三种固体质量相同,分别滴入相同体积且浓度为8%的稀盐酸,a处连接压强传感器,压强随时间变化图像正确的是( )。
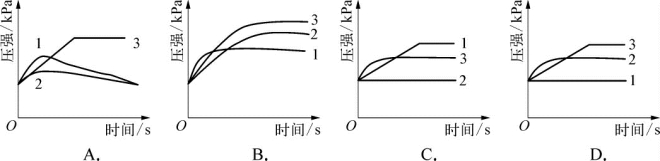
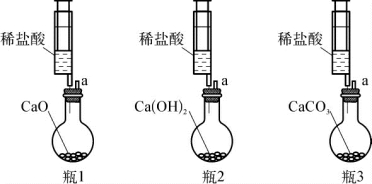
(第3-2题图)
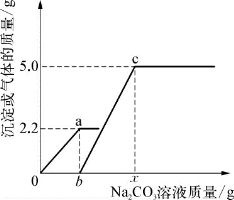
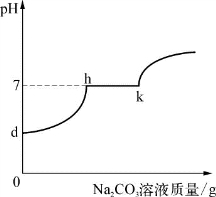
4-1.(2020·闵行·二模)小亮同学在实验室中制取CO2气体后,对废液进行后续探究,他向一定质量的含CaCl2和HCl的废液中逐滴加入溶质质量分数为10%的Na2CO3溶液。实验过程中加入Na2CO3溶液的质量与生成沉淀或气体的质量关系如图1所示;加入Na2CO3溶液的质量与溶液的pH变化关系如图2所示。
完成下列填空。
(1)图1中0a段的现象是_________________。
图1中bc段涉及反应的化学方程式是________________________________________。
(第4-1题图1)
(第4-1题图2)
(2)图2中dh段之间(不包含d和h两点)溶液的溶质有___________________________。
(3)下列说法错误的是_________(填编号)。
A.图1中bc段反应过程中溶液的pH变化对应图2中hk段
B.图1中a与b两点的溶液状态不同
C.由图1和图2可推断CaCl2溶液显中性
D.图1中x=2b
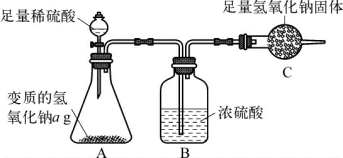
4-2.(2020·浦东·二模)为了测定ag变质氢氧化钠中碳酸钠的质量分数,设计了如图所示的实验方案(浓硫酸具有吸水性)。
【定量测定】
(第4-2题)
实验步骤和数据:①组装装置,检查气密性(气密性良好);②加入药品,称量C处装置质量为b g,滴入足量稀硫酸;③完全反应后称量C处装置质量为c g;④后续处理。
完成下列填空。
(1)判断碳酸钠已完全反应的实验现象是__________________________。
(2)利用实验数据,可得变质氢氧化钠中碳酸钠的质量分数为________________________(用字母表示)。
(3)所得实验结果存在一定的误差,可能的原因是_________________________________(写出一点即可)。
5-1.(2020·长宁·二模)某学习小组同学欲利用绿色粉末碱式碳酸铜[Cu2(OH)2CO3]制备金属铜,并进行相关的实验。
完成下列填空。
【实验一】制备氧化铜并检验产物,装置如图所示(省略夹持仪器)。
步骤一:打开弹簧夹,通入氮气。
步骤二:关闭弹簧夹,将装置A、B、C连接,并开始加热至A中固体质量不变,停止加热。
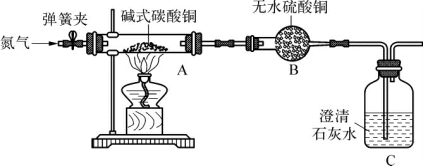
(第5-1题图1)
通入氮气的作用是____________________;实验过程中,观察到A中有黑色固体生成,B中无水硫酸铜变蓝色、C中澄清石灰水变浑浊。碱式碳酸铜受热分解除了生成氧化铜,还生成了____________________。装置C中反应的化学方程式为_______________________________________。
【实验二】用实验一中产生的氧化铜制备金属铜。
(1)方法一:用一定量炭粉与实验一中产生的氧化铜加热制取铜并检验产物。
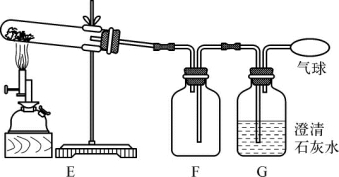
(第5-1题图2)
①实验过程中,观察到G中溶液变浑浊。E中试管内固体反应的化学方程式是__________________________;装置F的作用是________________________。
②实验反思:为何实验一中步骤二需要加热至A中固体质量不变,才停止加热。分析可能的原因是________________________________________________________。
(2)方法二:取适量实验一中产生的氧化铜,依据下列实验流程制取金属铜。
![]()
(第5-1题图3)
①步骤Ⅰ中反应的化学方程式是________________________________________,观察到的现象是_______________________________;步骤Ⅱ中滤渣的成分是__________________,在滤渣中加入过量稀硫酸反应化学方程式是_______________________________________。
②实验反思:在实验二中,你认为方法二优于方法一的理由是___________________________(写一条即可)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





