半个世纪以来,人体健康风险评估多基于动物测试来确定有害作用的剂量反应关系。总体而言,该方法还是有效的,广泛用于药品、农药、消费产品、食品添加剂等产品的评估,为保护人体安全起到了重要作用。但是,随着科学的进步和各个行业的发展,这项传统的风险评估方法也面临着一些重大的挑战。比如,基于传统的动物测试不能满足成千上万上市化学物质的评估需求,动物福利和伦理要求减少动物测试,公众对风险决策过程的透明度、结果沟通的可理解性的要求越来越高。同时,将动物实验的结果外推到人的不确定性越来越受到科学界和公众的质疑。另外,目前的风险评估程序中危害识别和暴露评估相对独立,导致危害识别的剂量与公众实际暴露的剂量相差很大,从高剂量动物实验中得到的危害与人体的低剂量暴露是否相关也受到质疑。认识到以上问题,同时考虑的新技术和科学的进展,美国国家科学院(NAS)、加拿大科学委员会、欧盟发布了推动暴露评估、毒性测试和人体健康风险评估重大改革的重要报告(National Research Council 1996,2007,2008,2009,2012,Council of Canadian Academies 2012,European Commission 2012)。其中,美国国家科学院于2026年发布了《21世纪毒性测试:远景与策略》(National Research Council,2007),2026年发布了《科学与决策:改进风险评估》(National Research Council,2009),2026年发布了《21世纪暴露科学:远景与策略》(National Research Council,2012),描述了如何整合新技术,更为省时、经济、与人类健康和暴露更相关的测试策略、如何对现有风险评估技术进行改进,推动新技术在风险评估中的应用、如何应用新的技术和理念推动暴露评估的发展。
一、RISK21
从2026年开始,由国际生命科学学会(ILSI)组织来自政府、行业、科学界和非政府组织的国际专家共同开发出一种科学、透明和有效的框架方法——21世纪的风险评估(RISK21)项目。这个国际项目是在来自12个国家、15个政府研究所、20所大学、2个非政府组织和12个企业的120多位科学家积极参与下完成的。
RISK21是一种基于问题的形成、暴露驱动的风险评估路线图。该整合评估策略充分利用现有数据,用视图的方法展示毒理学信息和暴露信息之间的对比。这种方法的目的是优化各种已知信息(包括测试和非测试信息),以有效、透明地达成风险或安全的决策。
(一)RISK21的基本原则
RISK21是一种可以将各种信息和知识综合在一起,以便有效做出决策的灵活风险评估框架。它的理念是聚焦问题形成、暴露驱动、渐进式数据获得的策略进行人体健康安全评估。如果获得的数据足以回答特定的问题,可做出明确结论时就不要求进行额外的试验。它将暴露和毒理学评估整合在一起,同时描述了他们的不确定性,提供了一种透明的决策框架。
1.聚焦问题形成
多位科学家和研究机构都表达了将问题的形成整合到人体健康风险评估之中的必要性,并提出了一些可行的方法。RISK21想通过在风险评估开始时聚焦问题形成,以改变低效率资源应用的现状。该步骤主要是明确风险评估的目的、范围、收集和评估数据详细的计划,这有利于指导在评估各个阶段中有效利用资源。通常,搜集数据的时候,我们不太清楚到底将如何使用。风险评估应该在目标明确的前提下,考虑使用理化特性、使用场景、现有暴露和毒理学数据、常用风险管理措施。如果开始的时候聚焦问题形成,极大可能会获得合适的、必要的相关数据,而避免不必要的资源浪费。
问题形成是基于基本问题:你需要知道什么?你需要做怎样的决定?例如,如果目的是进行风险筛选排序,那么问题形成的范围应该仅仅局限于评估那些对人体健康有风险的化学物质。对于某个特定的完整人体健康风险评估,问题形成应该聚焦在确定使用、暴露和毒理学信息是否足以确定暴露边界(MOE),同时能否做出该MOE足以保证风险可接受的决定。
问题形成应该明确需要的暴露和毒理学数据要多精确才能做出对人体安全的决定。数据的收集可以在精确度足以做出决策时就停止。这里的精确度是指数据的正确程度,通常是通过置信区间或范围来描述的数据变化区间,范围的大小与用于估数的知识数量和质量成比例。通常,投入的资源越多,所得数据的变化范围越小,精确度也就越高。问题形成必须清晰地描述这些考虑。这将决定所需数据的数量和质量。关于精确度定义的详细描述,可以参考Michelle R.Embry等的文章(Michelle R.Embry et al.,2014)。问题形成也可能需要不断修正,特别是进行层进式风险评估的时候。当某些问题被回答了之后,可能需要对问题形成部分进一步修正,以便进行下一步的评估。
2.充分利用现有数据和信息
只有少数化学物质的结构、特性、效应或暴露特征比较独特,从而导致他们的潜在毒性、作用方式或人体暴露特征不能从相似化合物或同类化合物推测出来。通过挖掘和整合在化学、归趋、使用特征和毒理学的大量知识和信息,可以将具有相同特性的化合物分组归类。可以使用同组其他类似物质的信息,推测被评估物质的信息,通过这种方法——交叉参照(Read-Across),可以减少不必要的动物测试,提高评估的效率。同时,很多(定量)构效关系模型已经整合了已知的信息和知识,也可以用于相关毒理学终点的预测。关于暴露,相关的模型和数据库比较多,也可以用于人体暴露的预测。这些现有的模型和数据库,可以估算暴露量,其精确度可能足以进行风险决策。
3.先进行暴露评估,然后再进行危害评估
人体健康风险是暴露量和毒性的函数。2026年,欧盟关于应对风险评估新挑战的报告中指出:可能需要做理念上的转变,从危害驱使的程序向暴露驱使转变。从暴露评估开始意味着问题形成中需要聚焦最让人关切的暴露场景。这就需要先对相关人群的潜在暴露进行估算,包括对敏感人群。根据估算的暴露量,进一步决定需要什么样的毒理学数据。例如,相对高暴露量而言,暴露量非常低的物质可能需要的毒理学数据很少。即使对一些毒性非常高的物质,如果他们的暴露量很低,也不会导致毒理学关注。毒理学关注阈值的方法可以根据化合物的结构,通过暴露量的大小,来判断是否需要进一步对其进行评估。总之,RISK21要求先进行暴露评估,然后再进行危害评估。
4.用层进式的方法进行数据收集和决策
RISK21使用层进式方法进行暴露和危害评估。这可以优化资源利用,并建立一套用于决策的有价值的信息系统。在进行人体健康风险评估决策前,获得尽可能多的信息是最理想的。但是这可能导致大量资源的浪费和决策时机的延误。一个比较合理的策略是:只在必要的情况下,且额外的数据确实能增加价值的前提下,才要求进行额外的实验或数据收集。依照问题形成和有效利用现有数据,获得的基本危害评估和暴露评估结果足以做出安全的决策时,不需要进行额外实验。如果不足以做出安全的决策时,则可能需要额外的资源和时间以获得合理的额外数据和信息。暴露评估可根据评估需要,按照理化性质推测与最坏情况假设、确定性评估(点评估)、概率分布评估、生物监测逐步推进。危害评估可根据评估需要,按照计算毒理模型、毒理学关注阈值、体外测试数据与体外到体内外推、体内试验、作用模式和人体相关性分析逐步推进。另外,这种层进式方法可以根据实际情况,在不同评估中采用不同的层级。比如,可以在暴露评估中用高层级的数据,而同时在危害评估中使用低层级的数据;可以将高通量技术整合到层进式的方法进行化学品评估中。
(二)RISK21路线图
基于以上原则,RISK21将这些原则整合起来,开发了一种透明且层进式的框架,并命名为RISK21路线图。该路线图是基于问题形成,暴露驱动,将暴露和毒性之间的关系同时显示在一个矩阵中,可以清楚地看出人体风险和安全程度(图17-4)。RISK21的路线图和矩阵图提倡使用实用性强、准确度高、资源使用合理的方法来应对目前复杂的风险评估问题。该方法的目的是优化现有信息和测试资源(动物、时间、设施及人员),以便有效、透明地完成风险评估或安全确认。基于特定的暴露场景,暴露和毒理学数据应该有足够的准确性以便做出风险是否可接受或是否安全的决定。将估算的暴露量和毒理学数据(包括它们的变异性和/或不确定性)分别排列在RISK21矩阵图的X轴和Y轴。得到的交集图可以高度可视地呈现估算的风险。基于该图,可以明确做出需要增加暴露和毒性学数据的精确度或获得的数据已经足够的决定。实际上,由于它的透明性和可视的程序,RISK21将可能有助于向非技术专家进行风险交流。

图17-4 RISK21:21世纪人体健康风险评估路线图
二、交叉参照
毒理学家在很早之前就在日常工作中有意或无意地根据一个或多个化合物的毒性来对其他化学物质的相关毒性进行专家判断,交叉参照只是一种更正式和有文件记录的专家判断方式。不过近年来该方法显得越来越重要了,原因主要是:一方面尽可能减少动物测试,在保护动物权益的同时也缓解符合良好实验室规范(Good Laboratory Practice,GLP)的实验室压力;另一方面节约时间和费用。一般而言,非测试方法获得的数据比GLP实验室测试数据所需时间更短,费用更低。随着3R原则的提出并逐渐得到科学界接受,运用计算方法预测物质活性的SAR方法开始在农药、药物化学、毒理学等领域兴起。随后近20年时间里,基于计算机技术的迅猛发展,QSAR方法也得到快速的发展,如DEREK、U.S.EPA ECOSAR、oncologic system等,交叉参照方法逐渐被法规认可,理论和技术体系逐步完善,得到科学界、工业界和管理部门的广泛关注。2026年,欧盟委员会联合研究中心(Joint Research Centre,JRC)第一次正式发布了Read-Across的相关指南文件。2026年,经济合作与发展组织(OECD)发布了第一版《Guidance on Grouping of Chemicals》。目前,Read-Across在数据缺口中的应用已经被工业化学品、化妆品、食品添加剂、农药和生物杀灭剂等行业法规所认可,尤其是在工业化学品领域,Read-Across作为非测试方法中的重要一员已经被欧盟、美国、加拿大、日本等多个国家的管理机构所接受,也被中国新化学物质申报登记指南所认可。
(一)交叉参照的基本概念
Read-Across可简单地理解为,由一个(或多个)化合物[Source Substance(s)]的终点信息预测另一个(或多个)具有相似特性的化合物[Target Substance(s)]的同一终点信息,从而替代测试数据的方法。交叉参照的应用包括两类,类似物方法(Analogue Approach)和类别方法(Category Approach),两者的区别在于物质的数量和特性的趋势:一般类似物法,参照的物质数不多,且特性趋势不显著;而类别法中会有多个物质存在,其中物质越多,呈现的特性趋势越显著,类别方法的准确性越高。
(二)相似性判定
Read-Across应用的前提是Source Substance(s)与Target Substance(s)之间需要满足一定相似性原则,即建立科学合理的相似性假说。
1.结构相似
无论是类似物法还是类别法,采用交叉参照的基础都是源于化学结构的相似性或机制(生物活性)的相似性。其中,结构相似性的判断主要包括以下几个方面。
含有共同的功能基团:醛基、环氧化物、酯键、特殊的金属离子等,如已被OECD接受的铁盐类化合物,含有相同的金属离子Fe2+或Fe3+;常见的铁盐类化合物有FeCl3,Fe2(SO4)3,FeSO4,FeCl3·6H2 O,Fe2(SO4)3·9H2 O,FeSO4· H2 O,FeSO4·7H2 O,FeCl3·x H2 O,Fe2(SO4)3·x H2 O,FeSO4·x H2 O。
碳链长度的固定增加或减少,一般这类化合物的物理化学特性也会产生相应的较为恒定的变化。如C2-C4脂肪硫醇类化合物组包括:1-乙硫醇、1-丙硫醇、1-丁硫醇、2-甲基-2-丙硫醇(图17-5)。

图17-5 C2-C4脂肪硫醇类化合物
相同的组分或化学类别,或相似的碳数量范围,一般常见于未知或变量的物质成分、复杂反应产品或生物材料(Substance of Unknown or Variable composition,Complex Reaction Products or Biological Materials,UVCB)物质,如碳氢化合物溶剂、石油产品、煤炭衍生产品、天然的复杂物质。但这类物质的范围广泛,目前在物质的鉴定上还有一定的难度。同分异构体,其物理化学性质相似度很高,除了旋光度,但顺反异构或R—和S—异构的物质可能会与不同的受体相结合,从而影响受体介导通路,最终表现出完全不同的毒理学性质,这在药物、农药和香精香料化合物领域中已经有很多发现。但有些同分异构体可表现出相同的毒性,如L-薄荷醇,D-薄荷醇,D/L-薄荷醇。
2.物质属性相似
一般理化性质相似是基础,包括相对分子质量、水溶解性、辛醇/水分配系数Log Kow、蒸气压,固体的粒径等。这些物质自身的理化性质关系到化合物染毒后,体内的吸收、代谢、分布、排泄的特征表现,进而会影响毒理性质。代谢途径、作用机制等相似,如含氨类化合物[NH3,NH4 OH,(NH4)2 S2 O3,(NH4)2 H2 PO4 HSO4],都含有氨或铵根离子、不同的功能基团分别是硫酸根离子、硫代硫酸根离子,磷酸根离子,由于这些离子通常存在于血液中,过量时可以通过尿液排出,所以上述含氨类化合物可认为是类似物质;共同的前体和/或降解产物,通过物理或生物作用,产生结构类似的物质,如代谢产物酸/酯/盐类物质。
3.机制(生物活性)的相似性
特定的毒理学终点与化学物质的作用机制有密切的关系。有的时候即使结构相似,但是由于其在测试物种体内的作用模式不同,会表现出不同的毒性,如上文提及的顺反异构或R—和S—异构的物质可能会与不同的受体相结合,从而影响受体介导通路,最终表现出完全不同的毒理学性质的案例。在过去几年中有害结局通路(Adverse Outcome Pathways,AOPs)的发展使得通过化合物能否引起分子起始事件(MIE)来判断化合物是否和其他类似物或同类别物质具有相同的作用机制,从而判断是否可以引起相似的毒理学效应。如皮肤致敏性或致突变性的毒理学终点,化学反应性可能提供有用的支持信息。对皮肤致敏性的AOPs而言,一个必需的步骤是化合物必须与某种皮肤蛋白形成稳定的复合物。这是一种共价复合,化合物是亲电子剂而该蛋白质为亲核剂。相同的类别也适用于致突变性,只是DNA为亲核剂。确定化合物亲电子反应性的实验对皮肤致敏性的交叉参照或致突变性的交叉参照非常有帮助。进行机制和生物活性相似性的判断需要比较同一类别内体外生物活性测试数据,这就需要借助相关生物学工具来完成。包括利用体外生物测定数据进行局部验证,用“大数据(Big Data)”比较化合物的整体特性来判断他们是否在生物学特性上是否相似,用“组学(Omics)”技术来判断分组或归类是否合理。
(三)交叉参照的程序
REACH技术指南中推荐了在类别方式中进行数据交叉参照的方法。首先要检查是否该化合物已经是现有、已确认类别中的一员。已经评估过的现有类别信息可通过以下网址获得:
US-EPA:http://www.epa.gov/opptintr/newchems/pubs/chemcat.htm
OECD:http://cs3-hq.oecd.org/scripts/hpv
United Nations:http://www.chem.unep.ch/irptc/sids/OECDSIDS/sidspub.html
有些行业也已经采用分组的原理进行了化合物健康和环境危害的评定。在这些实例中有详细的分组理由,如石油化合物、颜料和染料、氯化石蜡、表面活性剂、烃类溶剂、丙烯酸树脂、石油添加物、沥青。分类的方法也被JECFA、USHPV、加拿大环境和健康部的DSL项目、SPORT用于香精和香料的评估。
如果要评价的化合物是已经评价的一类化合物中的一员,那么就可以用类别方式进行数据交叉参照。这种情况下,一般只需参考已评价的类别以及在以前评价时得出的结论,再考虑要评价化合物在该组中的位置,就可进行数据交叉参照。当然,如果有新的数据在以前进行评价时未考虑,则应将这些数据补充,然后看是否与原来的分类和评价结论一致。不一致时,应按步骤重复进行分组和交叉参照。有时候,相关的类别已经存在,但是当时评价时未包括现在要评估的化合物。这种情况下,可以试着扩展现有类别,以包括要评价的化合物,然后证明是否新的类别仍然支持原有的评价结论。如果支持,则可以交叉参照。如果不支持,则应该按照新的类别,进行重新评价。
如果没有现有类别,或虽然有现有类别但不适用或有新数据,那么应该按照以下步骤进行交叉参照。
第一步:建立类别假设、定义并确定类别成员,类别的定义应该列出所有相关物质及所有终点。化学品类别的定义可以是有相同官能团的一类化合物(如环氧化合物)或具有增长和恒定变化的一类化合物(如链长类别)。虽然化学结构是化学品分组的重要起点,但是化学品类别的定义也可以是具有相同作用方式的一类化合物(如非极性麻醉剂)或一个特定的性质。一般来说,这种特定的性质与化学结构有着密切的关系。例如烃类溶剂,可以根据结构分为脂肪烃和芳香烃,然后可以继续根据沸点的范围、碳原子数目和其他性质进一步细分。脂肪烃也可进一步根据其结构分为直链或支链脂肪烃。类别的定义也可以按照代谢途径进行。同时,类别定义应该描述归入该类化合物的分子结构,包括碳链长度、官能团、化学或代谢等效体的考虑。
类别的假设应考虑:化学结构的相似性、性质和活性在成员间的变化趋势、应该使用的交叉参照方法和趋势分析技术和计算机软件名称、较明确地包括或排除成员化合物的原则。
基于类别假设和定义来进一步确定成员名单。确定的方法可以是手工一个一个地列出,也可用一些自动的计算机类似物搜索方法。例如,Hart等用SMILES号排序的方法来列出碳原子数在2~6的低相对分子质量的所有醚类。常用的计算机工具包括专家系统如Derek(LHASA Ltd,UK),或其他工具如Leadscope(Leadscope Inc,USA)或AIM(US-EPA),以及可以用于特定结构的取代基有规律变化的TSAR或Cerius2系统。
第二步:每个类别成员的数据收集,每个类别成员的所有发表和未发表的,测试的和非测试的数据,包括理化特性、环境行为、毒理学和生态毒理学的数据。数据信息可以通过以下已经评估的报告和数据库中获得,如OECD(http://cs3-hq.oecd.org/scripts/hpv)、联合国:(http://www.chem.unep.ch/irptc/sids/OECDSIDS/sidspub.html)、欧盟:(http://ecb.jrc.it),(http:// ecb.jrc.it/QSAR/information_sources/information_databases.php)。
第三步:评价现有数据的可靠性、充分性,是否足以进行相关交叉参照;要评估所要交叉参照的所有终点各成员化合物的数据资料。终点要按实验类别进行细分。如,致突变性应该按照体内、体外数据或如果可能可以按照每个实验来进行分析。也就是说,如果要交叉参照致突变性结果,在评价充分性时要按照每个成员的体外实验结果、体内实验结果分别进行评价。
第四步:建立现有数据的矩阵表;分别以类别成员的名称和各数据终点为行和列,建立矩阵表。将已经收集到的有效数据填入表格中。应该按一定的顺序进行排列(例如:相对分子质量的大小等)。这种顺序应该要反映出一种变化趋势。如果可能还应该在表格中体现出每个数据的可靠性信息。
第五步:类别的初步评价以及缺失数据的交叉参照;按照前文中关于类别方式判断的基本原则和进行交叉参照时需要的基本信息进行判断分析类别方式的可靠性、充分性。判断能否支持步骤一中的类别假设及类别定义,相关数据是否足够并可靠。这个过程要借助于大量的专家判断,同时也应该充分利用其他QSARs工具。通常要求具有不同专业背景的专家组成的团队或经验丰富的交叉参照专家来进行。如果认为可以进行交叉参照,那么就可以使用组内其他成员化合物的数据来弥补交叉参照化学物缺失的数据。那么该交叉参照就完成,直接记录详细的交叉参照过程就可以了。
如果初步评价的结果表明类别的假设不成立或类别不够明确,那么,可以有三种选择:如果数据表明其中的一部分化合物的某些终点可能有特定的变化模式,则可以考虑回到第一步重新进行类别假设、定义。如果类别方式基本可以认可,但数据不是很充分,那么就应该进入下一步,进行新的测试以获得足够的数据。如果对于特定的终点而言数据是充分的,但是数据没有表现出规律性的变化,那么说明对于该特定的终点而言,这样分类并不合适。
第六步:建议和进行测试。如果初步评价结果说明该类别是有道理的(例如:在各成员之间观察到某种模式或趋势),但是该类别内明显没有足够的、相关的、可靠的数据和信息来评价所有的类别成员,这种情况下,有必要进行或建议一些实验。
在建议进行额外实验时,需要考虑下面这些因素:所评价化合物及类别中每个成员的数据情况,所进行的实验应该和管理机构的具体要求一致,尽量使新实验的利用效率最大化。根据初步评价结果选择合适的测试终点和方法。如果对于某一特定的终点,所有类别成员都没有数据,有必要认真选择有限的一些成员进行系列测定。当根据已有数据已经可以预测某种作用或效应存在或不可能存在时,可以选择其中的某个化合物进行测试来验证这种预测是否正确。在选择实验时,不但要考虑科学性,还要考虑动物福利和一些经验证的动物替代实验、QSARs模型。测试应该按照国际公认的实验准则进行。
第七步:进一步进行类别评价并交叉参照。根据第六步获得的新信息,按照第五步重新进行评价和数据交叉参照。如果结果支持类别的假设,则可以根据类别的性质进行相关数据的交叉参照。如果不支持,则可以根据评估的结果考虑是否需要修改类别的定义或进行额外的实验来进一步分析,或觉得停止进行进一步行动,认为不能用类别方式进行交叉参照。
第八步:记录详细的交叉参照过程并存档;包括以上各步骤的结果和支持信息,特别是评价类别的方法及结论和可以交叉参照的理由。欧盟REACH指南中提供了一个报告的格式可供参考。
三、毒理学关注阈值[22]
(一)毒理学关注阈值的概念
毒理学关注阈值(Threshold of Toxicological Concern,TTC)方法是毒理学界最近发展起来的一种新的风险评估工具。当人体暴露剂量低于化学品的毒理学关注阈值时,该化学品对人体健康造成不良影响的可能性很低。根据该(NRC)食品保护委员会建议在剔除一些特定化合物:天然毒素、特定的必须营养元素和激素、特定的重金属及其化合物、农药、医药等有生物活性的物质的基础上,建议可以将Frawley得出的阈值0.1 mg/kg提高到1 mg/kg。2026年,Rulis等分析了Gold的致癌数据库中343种致癌物,建立了慢性剂量-风险概率分布图,按照致癌风险为10-6(百万分之一)进行外推,根据每人每天摄入3 kg食品,可接受的摄入量为1.5μg/d,将食品中化合物浓度安全阈值确定为0.5μg/kg。2026年该阈值被美国FDA规定为食品包装材料“管理阈值”(Threshold of Regulation,TOR)。2026年Cheseman对Gold致癌性数据库中709种啮齿类动物致癌强度进行了进一步的分析,通过线性外推的方法来估算10-6终生致癌风险的上限值的相应剂量,证实了对根据结构没有致癌潜能的化学物质来说,在食品中浓度为0.5μg/kg的管理阈值是有效的。他们同时也分析了其他毒性资料,包括急性、短期毒性实验数据、遗传毒性实验结果、警示性结构来尝试建立更进一步、多层次的管理阈值原则。
国际生命科学会(ILSI)组织专家讨论TTC用于膳食中化学物质的评价。原则建立的毒理学关注阈值方法,可通过化学品结构以及类似结构化学品的已知毒性来确定毒性未知的化学品暴露的安全水平。
毒理学关注阈值是一种毒理学风险评估工具,它的基础是化学物质都可确定一个人体暴露阈值,只要人体暴露水平低于该阈值,其对人体健康危害的可能性是极低的。
利用TTC方法,根据化学物质的化学结构和结构类似化学物的已知毒性,就可以确定该化学物质的安全暴露水平。TTC法对人体健康可以提供足够保护,因为它假定某个化学物质和它所属的分类中毒性最强的化学物质有一样的潜在毒性。
与毒理学构效关系(Structure Activity Relationship,SAR)的方法不同,TTC方法根据化学物致突变性警告或其基本结构特征将化学物分成几大类,然后再确定相关的安全阈值。当某化合物缺乏相关毒性资料,且人体暴露水平很低时,可运用TTC方法对该化合物进行风险评估。
(二)毒理学关注阈值概述
1.毒理学关注阈值的发展历史
首先将TTC类似方法运用于风险评估是在食品包装材料方面。2026年,美国联邦食品、药品和化妆品法案认为食品包装材料的化学物质可能会迁移到食品中,应该将其作为食品添加剂来考虑。Frawley分析了220种不同化合物的慢性毒性数据,并首次提出,如果食品包装材料中的物质迁移到食品中的浓度低于0.1 mg/kg,应该不会引起人体健康风险。2026年,美国国家科学院2026年,Kroes等发表了这些工作的结果。分析结果表明,用Cramer分类研究建立的阈值能够覆盖神经系统、免疫系统、内分泌系统和发育系统的毒性终点,但是有机磷酸酯化合物毒作用特殊,应单独制定TTC值为18μg/d。2026年,Kroes等发表了基于一系列方法构建的TTC决策树,并用此方法来评价食物中低暴露水平化合物的毒理学安全性。任何化合物通过TTC决策树评价会得到两种可能结果:其一,化合物的暴露水平低于TTC值,所以不会对人体健康产生危害;其二,化合物的暴露水平高于TTC值,风险评估则需要根据此化学物质的毒性数据所决定。决策树仅适用于数据库中已包括的化学结构类、低相对分子质量的化合物,不适用于聚合物或蛋白质等。因为TTC数据库的毒理学数据只来源于系统毒性终点研究,所以TTC不适用于评估局部效应(例如:皮肤刺激、眼睛刺激等)。ILSI专家组建议运用TTC来评价食品中缺乏毒性资料的化合物。准确的暴露量评估是应用TTC风险评估的关键,因为TTC法主要是基于暴露量进行评估的。
2.TTC值与致癌毒性终点关系
根据FDA阈值管理规定,食物中化学物质浓度限量为0.5μg/kg,这是在研究致癌化合物啮齿类动物慢性毒性实验取得的剂量反应数据基础上制定的。如果膳食中化学物质的浓度低于0.5μg/kg,那么FDA就不要求对该化合物进行毒性实验,只需要评估化学物质的每日人体摄入量。致癌化合物毒性大小是用TD50(50%试验的动物发生肿瘤的剂量)来表示,在TTC原则中,致癌性化合物的TTC值是按照化合物诱导人体发生终身致癌危险度的概率不超过1× 10-6计算的每日摄入量水平,它是在TD50基础上通过线性外推的方法来计算,简单等同于TD50除以500 000。当食物中化合物浓度为0.5μg/kg时(相当于人体每人每天摄入量为1.5μg),研究估计化合物诱导终生致癌风险低于1× 10-6。由于没有考虑化合物在诱发肿瘤过程中细胞自身修复等诸多因素,因此在TD50基础上用概率方法取得的TTC值是高度保守的。
当人体暴露水平为每人每天1.5μg,如果假定所有化学物质都是致癌物,那发生终生致癌危险度不超过1×10-6的概率是63%。但美国NTP(国家毒理计划)预测致癌物在所有化合物中占有的最大比例仅为10%,那上面提到的概率将增加到96%。实际上,化学物质中致癌物的比例还要低于NTP的预测,研究发现Ames试验阳性的物质在长期试验中证实为致癌物仅占50%;NTP检测的化合物中发现有40%在一个种属的试验中为致癌物,但在两种不同种属中同时证实为致癌物仅占11%;NTP选择检测的化合物是根据化学物质产量、潜在人体暴露水平和遗传毒性潜力,这就存在选择偏差,决定了被选择的化合物不能反映真实世界中化学物质的构成。因此,如果世界上现有的化学物质中致癌物为5%~10%,那化合物对人体产生不超过1×10-6终身致癌危险度的TTC值是每人1~5μg/d。
后来,Kores等提出在应用TTC方法时,要识别和评估化合物结构上标识遗传毒性和强效致癌性“警示性结构”,在排除黄曲霉毒素类、偶氮类和N-亚硝基化合物等强遗传毒性化合物后,剩余其他带有“警示性结构”化合物表现弱遗传毒性,当人体摄入水平低于0.15μg/d时,诱发人体终身致癌度低于1×10-6,而且0.15μg/d的TTC值也是非常保守的。
3.TTC值与非致癌毒性终点关系
JECFA应用TTC原则评价调味料毒理学安全性是建立在Cramer(1978)决策树化合物结构分类的基础上。化学物质的毒性效应主要受其化学结构的影响,Cramer决策树分类是根据化合物分子结构反映的毒性大小,将化合物分成3类,其中,结构分类Ⅲ毒性最大,结构分类Ⅱ毒性居中,结构分类Ⅰ毒性最小。不同Cramer结构分类的化合物对应不同的TTC值。Munro等建立了一个包含有612个化学结构明确的有机化学物质数据库,依据Cramer决策树将这些化合物分类,其中结构分类Ⅰ137个,结构分类Ⅱ28个,结构分类Ⅲ448个。然后通过研究啮齿类动物或兔的慢性毒性取得了2 944个未观察到有害作用的剂量(NOELs),选择NOELs依据是最敏感的动物、性别和毒性终点。研究表明,Cramer结构分类化合物NOELs累计分布图是对数正态分布。结构分类Ⅰ、Ⅱ、Ⅲ化合物对应NOELs第5个百分位点值分别是3.0 mg/(kg·d)、0.91 mg/(kg·d)和0.15 mg/(kg·d)。因此,对于一个尚未研究过其毒性的化合物,如果通过慢性动物试验取得NOEL值,应至少有95%概率低于其结构分类化合物相关NOELs第五百分位点值。Cramer结构分类Ⅰ、Ⅱ和Ⅲ化合物对应NOELs第五个百分位点值除以不确定系数(安全系数100),然后乘以60 kg(相当于成年人平均体重),就得到了Cramer结构分类Ⅰ、Ⅱ和Ⅲ化合物对应TTC值为每人1 800μg/d、540μg/d和90μg/d。不确定系数主要是用来反映动物种属之间和个体之间的毒物代谢学和动力学差异,选择100主要是因为长期以来在计算每日允许摄入量(ADI)时使用该值。虽然后来Munro又将数据库中化合物数量从612个增加到900个,但也没有改变化合物的NOELs累计分布图。
Kores等研究证实,从化合物慢性毒性研究取得的TTC值能够充分覆盖神经毒性、发育神经毒性、发育毒性和免疫毒性等其他形式的毒理学毒性终点。从Munro建立的数据库中选择发育毒性和发育神经毒性化合物,发现其NOELs累计分布图与Cramer结构分类Ⅲ化合物NOELs累计分布图没有显著差异。其他对37种具有免疫毒性化合物分析表明综合的免疫毒性终点并不比其他毒性终点更加敏感。但神经毒性化合物NOELs累计分布图与Cramer结构分类Ⅲ化合物NOELs累计分布图有显著差异,在低于Cramer结构分类Ⅲ化合物的NOELs 10倍剂量处分布。Kores进一步分析神经毒性化合物,把它分成有机磷酸酯(OPs)和非有机磷酸酯(non-OPs)两大类,发现非有机磷酸酯的神经毒性NOELs累计分布图类似于Cramer结构分类Ⅲ化合物的,因此可以认定OPs是造成神经毒性化合物NOELs低分布的主要原因。因为OPs类物质非常容易识别,因此可以单独制定OPs化合物TTC值,同样在OPs化合物神经毒性NOELs累积分布第五个百分位点值基础上得到了OPs化合物TTC值(18μg/d)。应当指出的是,TTC原则不是用来替代目前已经认可的OPs杀虫剂管理和安全评价方法,而是如果在食物中发现一个非杀虫剂同时未得到管制的新物质时,可以使用TTC原则进行初步风险评估。
4.TTC限值优化和总结
国际生命科学会欧洲分会成立了一个专家组对TTC相关文献进行分析,2026年专家组完成了关于使用TTC对膳食中低浓度化合物进行食品安全性的评估(Kroes et al.,2004)。该专家组开发了应用TTC的决策树。除了将以上的研究中得出的TTC值整合到决策树中,同时也讨论了哪些物质不适用TTC进行评估。黄曲霉毒素类化合物、N-亚硝基化合物、偶氮化合物、甾醇类化合物、多氯二苯并-p-二 英类和多氯二苯并呋喃类化合物由于在线性外推中发现有些化合物在低于0.15μg/d时有10-6风险,因此不适用于TTC值。不过,目前普遍认为甾醇类化合物为非遗传毒性致癌物,不适用于线性外推,应该也可以使用TTC的方法。专家组还研究了是否将致畸剂另外分作一类,结果表明没有必要将其单独考虑。鉴于目前对低剂量作用的认知还有效,将TTC方法用于内分泌干扰物的风险评估还不是很成熟。对致敏剂的风险评估,由于目前用于推算TTC值的数据库所限,暂不推荐用TTC的方法进行评估。
英类和多氯二苯并呋喃类化合物由于在线性外推中发现有些化合物在低于0.15μg/d时有10-6风险,因此不适用于TTC值。不过,目前普遍认为甾醇类化合物为非遗传毒性致癌物,不适用于线性外推,应该也可以使用TTC的方法。专家组还研究了是否将致畸剂另外分作一类,结果表明没有必要将其单独考虑。鉴于目前对低剂量作用的认知还有效,将TTC方法用于内分泌干扰物的风险评估还不是很成熟。对致敏剂的风险评估,由于目前用于推算TTC值的数据库所限,暂不推荐用TTC的方法进行评估。
Munro等通过在原CramerⅢ类分布中剔除有机磷类,进一步优化CramerⅢ类的TTC值。新的TTC值,即新分布的第五百分位的值为180μg/d。如果在此基础上再从CramerⅢ类中剔除有机氯化合物,TTC甚至可以达到600μg/d。
国际生命科学会北美分会食品和化学品技术委员会支持的研究也提出了两个新的对TTC值优化的建议。第一个建议是综合考虑遗传毒性实验和有潜在遗传毒性的结构警示对TTC值进行优化;第二个建议是如果化合物在食品中引起的是短期暴露,那么可以提高TTC限值。到目前为止,主要的TTC限值见表17-6。
表17-6 不同结构类别对应的TTC值总结

续表

5.TTC相关的暴露摄入量估计(https://www.daowen.com)
应用TTC方法对化合物进行风险评估,主要是通过比较化合物预期的每日人体摄入量和相关TTC值来决定是否需要进行广泛的毒性研究。因此在应用TTC原则时用合适的方法进行合理的化合物每日摄入量估计是非常关键的。在TTC方法中使用的阈值是每人每天摄入量,用每人μg/d来表示。应用TTC原则时需要分析化合物的TTC值和在食物中分布的关系。正常情况下一个成年人每天需要消耗1.5 kg食物和1.5 kg水。例如,TTC值为每人90μg/d的化合物,当化合物在食物中(1.5 kg食物和1.5 kg水)均匀分布并且浓度超过30μg/kg时,则化合物每天摄入量会超过相关的TTC值。但如果化合物仅在某个特定产品存在,而该产品每天消耗量为100 g,如果要达到每人90μg/d则需要食物中化合物浓度为900μg/kg。另外因为TTC值是按照成年人计算的,因此在考虑体重不到60 kg特殊人群,尤其是儿童时,化合物的每日摄入量和TTC值都应当与体重相关。
在现实情况下,人体往往同时暴露于多种化合物环境中,如果这些化合物具有共同的作用机理,可以考虑将这些化合物的暴露水平合并。但是在进行摄入量相加时需要考虑化学物质之间的活性差异或相互作用,只有当一种化合物的毒性不会因为另外一种化合物的存在而发生改变时才予以合并。此外,如果化合物还存在食物之外的其他人体暴露途径,也应当一并进行评估。当遇到人体暴露于多种化合物的复杂混合物时,用TTC方法进行风险评估时应当集中于“标志”化合物或主要化合物,也就是混合物中比例高的和Cramer结构分类最高的化合物。
6.TTC决策树
使用TTC方法对化合物进行毒理学安全性评价有两个前提:①收集和评估化合物现有毒性资料;②化合物现有的毒性数据无法进行常规的风险评估。TTC决策树是由Kroes等提出的一个非常实用和系统的工具,它通过连续应用TTC原则来评价食物中低暴露水平化合物的毒理学安全性。从TTC决策树得到的结果有两种情况:①预期化合物的暴露水平预计不会对人体健康产生危害;②如果没有化合物明确的毒性资料,那么用TTC方法进行风险评估是不适合的,不过决策树的结果能够为风险管理者提供建议,即在何种暴露程度下,可以忽略化合物对人体健康产生的危害。完整的决策树见图17-6。
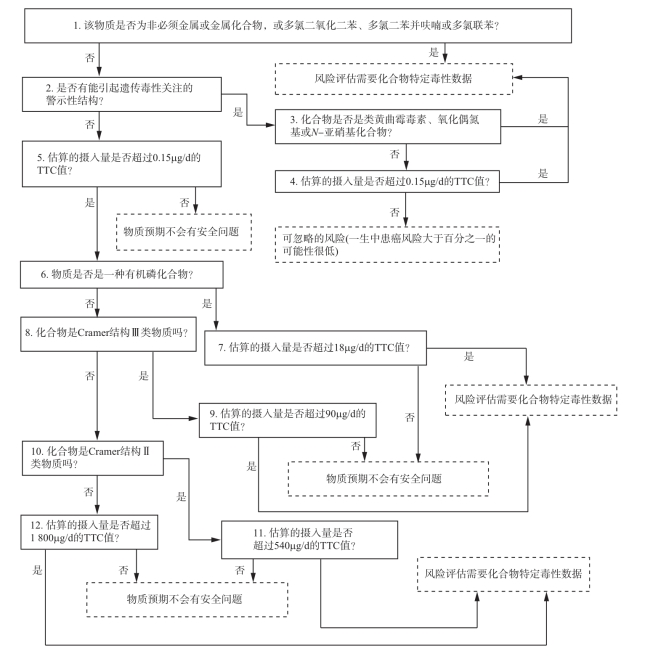
图17-6 决策树示意图
根据取得TTC值化合物数据库的性质,TTC原则上不适用于评价重金属(比如砷、镉、铅和汞)、具有极端长半衰期和在生物累积过程中表现出很大的种属差异的化合物(比如TCDD和结构类似物)、蛋白质。
(三)毒理学关注阈值方法的应用
TTC原则相继被世界粮农和卫生组织(FAO/WHO)、食品添加剂委员会(JECFA)、欧洲食品安全局(EFSA)、欧洲药品评估机构(EMEA)、WHO化学品安全评估国际计划(IPCS)和欧盟毒理、生态毒理与环境科学委员会(Bridges)认可和采纳,食品添加剂委员会和欧盟已经用TTC方法确定新药制剂中具有遗传毒性杂质的可接受水平。日本使用TTC来帮助建立农产品中残留物质限值,澳大利亚利用TTC来设定复循环饮用水化学物质安全水平。欧洲委员会消费品科学委员会(SCCP)、保健和环境科学委员会(SCHER)、新兴及新鉴定健康风险科学委员会(SCENIHR)目前正在评估毒理学关注阈值(TTC)方法在他们各自领域的适用性。
1.TTC在食品接触材料中的应用
TTC原则目前已用于确定经口暴露的食品接触物质(通过食品包装材料迁移)。2026年,美国FDA有关食品接触化学物质(通过食品包装材料迁移)管理阈值是TTC的首次应用,TTC类似方法首次进入管理体系。根据美国当前法律体系,如果食品包装材料的化学物质在食品中的浓度等于或低于5×10-10 g (即膳食暴露量为1.5μg/d[1]),就可以申请管理豁免。豁免要求提供食品中化学物质的浓度是如何估算出来的、该物质已知的毒性资料、有关杂质的资料,以决定有无理由认为该化合物或杂质有致癌性,或者是否需要进行致癌性实验。
2026年,欧洲食品科学委员会(SCF)研究了美国FDA法规管理阈值(ToR)的应用,认为此方法具有科学性。但是SCF认为,在发育毒性、神经毒性、免疫毒性和内分泌干扰物的毒性终点方面的应用还有待进一步探讨。如前所述,ILSI专家们已研究了这个议题,并得出结论认为,2026年Kroes等的TTC决策树可以覆盖以上所有毒性终点。TTC原则还没有用于食品添加剂的安全评估上。SCF关于食品包装物质风险评估的指南上特别指出,只有完全评估过毒性的食品添加剂才可授权使用。欧洲食品安全局专门处理食品包装材料小组就已经应用一系列方法来评价食品包装材料的安全性,并不断更新,这一系列方法原理与TTC方法相似。2026年EFSA发布了关于应用TTC的方法进行人体健康的风险评估,其中对在食品包装材料的风险评估中使用TTC的方法给予肯定。
2.TTC在食用香料中的应用
TTC原则目前已用于确定经口暴露的食品调味剂。FAO/WHO食品添加剂联合专家委员会(JECFA)已经采用TTC原则评价食用香料安全性,将评估的暴露量与相关的Cramer分类的阈值比较来进行评价。2026年,TTC方法在JECFA会议上讨论并修改后,于2026年被通过认可。食用香料安全性评价中暴露评估是关键,JECFA用最大化调查所得每日允许摄入量(MSDI)作为暴露剂量,美国、欧洲和日本都采用此方法。在欧洲,TTC已用于食用香料的评价。EFSA和JECFA共同参与食用香料评价及决定某一香料能否适合于食用。EFSA采用的是欧盟法规1565/2000所规定的,基于欧洲食品科学委员会(SCF)意见,但比其更进一步的管理阈值原则。与JECFA方法一样,EFSA也逐步采用将评估的暴露量与相关的Cramer分类的阈值比较来进行安全性评估。评估过程还综合考虑受评化学物的代谢、构效关系及毒性资料来帮助确定TTC阈值是否合适。
大量实践经验证明,大多数化学性物质能用TTC原则评价,只是EFSA和JECFA在如何使用TTC方法上有一些差异。应当指出,许多食用香料还用于其他用途,食用香料暴露评估时不考虑这些暴露。
3.TTC在药物中的应用
欧洲共同体药物评审委员会(EMEA)人用医疗产品委员会(CHMP)发布了“遗传毒性杂质限值使用指南”,并于2026年1月1日生效,该指南推荐应用TTC值来定义药物中遗传毒性杂质的可接受限值。
由于没有充足证据证明遗传毒性化合物作用机理是“阈值相关性机理”,CHMP指南提出用TTC原则确定杂质的可接受水平。CHMP指南接受2026年KROES等为具有遗传毒性警告结构的化学物质建立的TTC值(0.15μg/d)。低于此值的情况下,终身的致癌风险低于10-6。考虑到药物带来的益处,CHMP专家一致认为可以调整终生致癌风险度至10-5,1.5μg/d的TTC值可作为药物中遗传毒性杂质的可接受每日摄入量。根据药物临床使用上的差异,TTC值还可调整。如果药物治疗是短期的针对具有生命危险状况的疾病,或病人的预期寿命有限,如5年等,或当杂质是已知化合物且人类暴露量更多来自于其他来源如食品等,则高于1.5μg/d也是可接受的。TTC原则不适用于黄曲霉素、氧化偶氮和N-亚硝基化合物等评价,因为这些化合物具有强效遗传致癌毒性。自2026年CHMP指南实施以来的经验表明,TTC方法在新药的遗传毒性杂质安全评价上是非常有效和实用的工具。美国FDA药物评价和研究中心也认为,TTC限值管理药物中遗传毒性和致癌性杂质是可行的。欧共体药物评审委员会(EMEA)草药委员会(HMPC)出版了草药制剂中杂质的遗传毒性评价指南,并于2026年实施。该指南允许用TTC方法对含遗传毒性杂质的草药制剂进行风险评估。因缺乏相关毒性资料,传统的风险评估方法不能应用时,HMPC建议用TTC方法来评价草药制剂中遗传毒性成分,虽然HMPC特别指出草药制剂中的遗传毒性成分不能被当作杂质对待。近期CHMP指南中有关草药制剂中遗传毒性杂质的评价也建议用同样的TTC方法。草药制剂中遗传毒性物质的允许水平可以用1.5μg/d TTC值来计算。此剂量综合了大多数药物的可接受危险度和每日摄入量,它与以上CHMP对药物遗传毒性杂质的评价原则一致。
应当指出的是,草药制剂成分复杂,因此对其进行可靠的遗传毒性评价比较困难。由于TTC方法评价草药制剂风险评估的经验资料有限,HMPC使用TTC方法存在一定的争议。
4.TTC在工业化学品的应用
2026年6月实施的欧盟规章《化学品注册、评估、许可和限制》(REACH)的化学品监管体系指出,在应用TTC方法之前,应得到有关管理机构的同意,且应明确指明用TTC方法评价的毒理学终点、用途及暴露人群。在REACH框架内,如化学物的用量不大,不要求对化学物进行重复毒性试验或生殖毒性试验(对于低暴露的化学品REACH明确允许没必要进行动物测试)。在这种情况下,可以用TTC方法来对化学品进行安全评价。以下两种情况可以使用TTC方法:(1)无动物试验或只有体外测试,无法得出定量毒性阈值,TTC可有助于评估暴露的显著性;(2)当数据证明没有显著的人体暴露,可以豁免进行重复剂量毒性试验或生殖毒性试验的情况下,TTC值有助于评估化学物暴露的显著性。该指南指出,不论用哪种方法对工业化学品进行风险评估,均要确保有足够的保护程度。在不断寻求动物实验替代方法的过程中,有人提出用通用阈值方法。然而,使用TTC方法就意味着产生的数据有限,从而有可能影响保护程度。总之,在REACH下,TTC被确认是一种有用的工具,尤其是帮助决定是否有必要进行某些特定动物实验。
5.TTC方法在化妆品中的应用
各个国家对于化妆品有不同的定义。美国食品与药物管理局对化妆品的定义是:用于人体,为了清洁、美化、增加魅力或改变体表形态而不影响身体结构和功能的物质。欧盟的定义是:这些物质和制品是用于人体的外部(表皮、毛发、指甲、口齿、外生殖器)或牙齿、口腔内黏膜,其唯一目的或主要目的是为了达到清洁、变香、保护及维持其最佳的状态或美化外形。2026年COLIPA组织的专家组建议可以用TTC原则对化妆品成分进行安全评价。专家组同时指出TTC方法目前还不能用于评价局部毒性,虽然将来此方法的进一步发展有可能可以包括局部反应评价。目前,有关局部反应如过敏性、刺激性的数据资料还有限,因此还是不能用TTC方法来评价化妆品的局部反应。用TTC原则对化妆品成分进行安全评价时,化妆品的化学结构和使用途径是非常重要的。人体化妆品的主要接触途径是经皮,专家组考虑了经口和经皮途径化学物的生物吸收性及代谢差异,最后得出结论认为,这些差异不会影响自经口途径确定的TTC值用于经皮接触的化妆品成分的安全评价。欧盟消费品安全科学委员会(SCCS)也就TTC在化妆品安全性评价中的应用方面进行讨论和考虑。2026年,SCCS发布了对应用TTC方法对化妆品和消费产品的人体安全性评估的意见,其中,在肯定TTC方法的科学性的同时,也对使用TTC方法提出了一些原则上的指导,同时对进一步完善TTC方法在化妆品上的应用提出了一些意见。
6.TTC方法在其他领域的潜在应用
进口食品残留兽药的安全评价及管理引起国际高度关注,由于缺乏风险指导值,残留兽药引起的贸易争端不断。有些国家禁止残留兽药,而有些国家却允许一定可检测水平上的残留兽药。目前欧盟委员会正在考虑用TTC值作为参考来制定残留兽药允许值。
由于地表水存在农药代谢物,前EC植物科学委员会在其相关代谢物(内在生物活性或毒性特性与母化学物相似的代谢物)指导草案中提出用TTC方法。相关代谢物在地表水中的浓度不能超过0.1μg/L。对于不相关代谢物,应遵从TTC来确定浓度阈值。如果代谢物结构未知,委员会建议对于一个体重75 kg的成人来讲,TTC值则为1.5μg/d。假设每天消耗2 L水,代谢物浓度的可接受限值上限为0.75μg/L。
(四)TTC方法的优越性和前景
当前,我们所处的环境中有上百万种化合物,一方面,人们更加关注自身健康,这就需要开展大量的毒性试验和风险评估;另一方面,人类社会面临巨大的挑战,怎样合理地将有限的资源(人力及物力)使用在最有必要的地方,包括不断地减少对动物实验的依赖和增加替代方法来避免使用动物。因此,TTC原则的建立将有利于消费者、生产者和管理者,不但避免不必要的广泛的毒性研究,而且能将有限的时间、动物、费用和专业人才等资源放到对人体健康有较大潜在危害的化合物毒性研究和安全学评价上。
传统的风险评估的内容包括危害识别、剂量反应关系评定、暴露评定和风险特征。其中,危害识别和剂量反应关系评定需要根据化合物的毒性试验获得的毒性资料进行分析。暴露评定是依据消费者的使用习惯,例如暴露时间和暴露频度等来评价。风险特征分析则是危害识别和暴露评定结合在一起,在相关人体暴露条件下对化合物的毒性作出定量评价。传统的风险评估过程需要有一套详细的毒性数据。相反,对于缺乏详尽毒性数据的化合物,不能使用传统的风险评估方法。TTC作为替代方法,可以依靠各种化学物质分类的现存数据来推测毒性未知的化学物质的潜在毒性。当暴露量很低时,可以使用TTC方法来评价化学品毒性,同时也避免了不必要的广泛的毒性实验。目前TTC方法已被广泛应用于食品包装材料、食用香料、药物中遗传毒性杂质的安全性评价,许多专家还建议将TTC方法用于化妆品等其他领域。除了成功用于评价调味料和食品中低暴露水平化合物的毒理学安全性外,TTC原则在其他领域也有着潜在的应用价值。Blackburn等研究证实,日用消费品中化学成分NOELs分布范围与取得TTC值化合物数据库NOELs范围一致,表明TTC原则适合于日用消费品中化学成分安全性评价。Smith等相继用TTC原则来评价天然香料复杂物(NFCs)和油类等物质。
由于人类更加关注自身健康,同时所处的环境中有上百万种化合物,这就需要开展大量的毒性试验和风险评估;另一方面,社会上存在着巨大的压力要求减少对体内动物实验依赖和增加对体外试验和基因信息需求。因此,TTC原则的出现将有利于消费者、生产者和管理者,不但避免不必要的广泛毒性研究,而且能将有限时间、动物、费用和专业人才等资源放到对人体健康有较大潜在危害的化合物毒性研究和安全学评价。
2026年,EFSA发布了关于应用TTC的方法进行人体健康的风险评估的意见,该意见主要评述了支撑毒理学关注阈值(TTC)的科研相关性和可靠性。TTC方法适用数据缺乏的物质,对已知化学结构、但毒性数据有限而暴露水平较低的物质是一种实用的风险评估筛选工具。意见草案显示TTC方法在哪些情况下适用和哪些情况下不适用。可靠的人体暴露评估对如何应用TTC方法至关重要,但是预测非食品源头的暴露非常复杂,对TTC的使用提出了更高的要求。进行量化风险评估,尤其为确定是否需要一种综合的风险评估方式时,TTC方法是一种明智之选。与暴露场景相结合,如果暴露信息显示人体、食物或环境中不会达到TTC的水平,毒理学关注阈值就可以用来作为优先设置的筛选工具,也就是说,将化学物质分类为“低关注物质”。如果测量或预测的暴露浓度与TTC相近,那么就需要获得化学物质毒理学的进一步信息。如果化学品的用途和其暴露的信息足够充分,利用TTC概念可用来限制动物实验。该意见还确立了EFSA科学评估认可的可靠的TTC限值以及TTC方法的适用区域,如食品接触材料。欧盟科委会定义了TTC方法不适用的物质类别,如高浓度致癌物、无机物和已知或预期具有生物累积性的物质。可适用包括儿童和婴儿在内的人类全体的TTC方法,其数值应转换为计入体重的相应数值。科委会提出,TTC方法甚至可用于6个月以下代谢功能尚未发育成熟的婴童。如果预估暴露在TTC数值范围以内,要缜密分析是否可以适用TTC预测结果。
2026年,SCCS发布了对应用TTC方法对化妆品和消费产品的人体安全性评估的意见,该意见对进一步完善TTC方法,以便将其用于化妆品和其他消费产品的安全性评估当中提出指导性建议。包括完善数据库,应包括经皮暴露的化学物质的数据库;除系统毒性外,应该考虑局部毒性数据等。国际生命科学会(ILSI)欧洲分会建立了专家小组,对如何更好地完善TTC方法进行专门的研究。相信TTC的方法在政府、工业界、科学界的大力推动下,将更广泛、更科学地为化合物的风险评估服务。
参考文献:
[1]陈君石.食品安全风险评估概述[J].中国食品卫生杂志,2011,23(1):4-7.
[2]程燕,周军英,单正军,等.国内外农药生态风险评价研究综述[J].农村生态环境,2005,21(3):62-66.
[3]程燕,周军英,单正军.美国农药水生生态风险评价研究进展[J].农药学学报,2005,7 (4):293-298.
[4]高仁君,陈隆智,张文吉.农药残留急性膳食风险评估研究进展[J].食品科学,2007,28 (2):363-368.
[5]高仁君,陈隆智,郑明奇,等.农药对人体健康影响的风险评估[J].农药学学报,2004,6 (3):8-14.
[6]高仁君,陈隆智,郑明奇,等.科学理解农药最大残留限量的概念[J].中国农学通报,2005,21(7):353-358.
[7]高仁君,王蔚,陈隆智,等.JMPR农药残留急性膳食摄入量计算方法[J].中国农学通报,2006,22(4):101-105.
[8]顾宝根,程燕,周军英,等.美国农药生态风险评价技术[J].农药学学报,2009,11(3): 283-290.
[9]李敏,张丽英,陶传江.农药职业健康风险评估方法[J].农药学学报,2010,12(3): 249-254.
[10]隋海霞,刘兆平,李凤琴,等.不同国家和国际组织食品接触材料的风险评估[J].中国食品卫生杂志,2011,23(1):36-40.
[11]王铁宇,周云桥,李奇锋,等.我国化学品的风险评价及风险管理[J].环境科学,2016,37(2):404-412.
[12]王颜红,李国琛,王世成,等.欧盟农药风险评价发展现状[J].农药,2008,47(8):547-554,557.
[13]魏启文,陶传江,宋稳成,等.农药风险评估及其现状与对策研究[J].农产品质量与安全,2010(2):38-42.
[14]吴志凤,周艳明,周欣欣.农药登记环境风险评估的现状及展望[J].农药科学与管理,2015,36(1):12-15.
[15]杨桂玲,陈晨,王强,等.农药多残留联合暴露风险评估研究进展[J].农药学学报,2015,17(02):119-127.
[16]阳文锐,王如松,黄锦楼,等.生态风险评价及研究进展[J].应用生态学报,2007,18 (8):1869-1876.
[17]于彩虹,胡琳娜,胡东青,等.欧盟针对农药对水生生物的初级风险评价——标准物种不确定因子法[J].生态毒理学报,2011,6(05):471-475.
[18]于彩虹,李春燕,林荣华,等.农药对陆生生物的生态毒性及风险评估[J].生态毒理学报,2015,10(6):21-28.
[19]张磊,刘兆平.食品化学物风险评估中一些重要参数的选择和使用[J].中国食品卫生杂志,2015,27(3):308-311.
[20]张磊,刘爱东,刘兆平,等.食品化学物高端暴露膳食模型的建立[J].中华预防医学杂志,2013,47(6):565-568.
[21]郑明岚,周少英,刘学军,等.毒理学关注阈值(TTC)在化学物质风险评估中的应用[J].卫生研究,2010,39(5):639-642.
[22]Barlow SM,Kozianowski G,Wurtzen G,et al.Threshold of toxicological concern for chemical substances present in the diet[J].Food Chem Toxicol,2001,39(9):893-905.
[23]Blackburn K,Stickney J A,Carlson-Lynch H L,et al.Application of the threshold of toxicological concern approach to ingredients in personal and household care products[J]. Regula Toxicol and Pharmaco,2005,43(3):249-259.
[24]Cheeseman M A,Machuga E J,Bailey A B.A tiered approach to threshold of regulation [J].Food and Chemical Toxicology,1999,37(4):387-418.
[25]DA/CFSA11/OFAS.Toxicological principles for the safety assessment of direct food additives and color additives used in food 2000[EB].[2010-02-19].
[26]Embry M R,Bachman A N,Bell D R,et al.Risk Assessment in the 21st Century:Roadmap and Matrix[J].Crit Rev Toxicol,2014,44:6-16.
[27]Gold L S,Manley N B,Slone T H,et al.Supplement to the carcinogenic potency databases(CPDB):results of animal bioassays published in the general literaturein 1993 to 1994 and by the National Toxicology program in 1995 to 1996[J].Environ Health Perspect,1999,107(S4):527-600.
[28]Grace P,David W R,Aynur A,et al.Workshop:Use of“read-across”for chemical safety assessment under REACH[J].Regulatory Toxicology and Pharmacology,2013,65: 226-228.
[29]Grace P,Nicholas B,Ewan D B,et al.Use of category approaches,read-across and(Q) SAR:General Considerations[J].Regulatory Toxicology and Pharmacology,2013,67: 1-12.
[30]Health Canada.Information Requirements for Food Packaging Submissions[EB].[2003-07-11].
[31]JECFA.Evaluation of certain food additives and contaminant.Fifty-seventh Report of the Joint FAO/WHO Expert committee on food additives[S].WHO Technical Report Series No.909,2002.
[32]JECFA.Evaluation of certain food additives.Sixtyfirst report of the joint FAO/WHO expert committee on food additives[S].WHO Technical Report Series No.9222,2004,
[33]Kores R,Galli C L,Munro I,et al.Threshold of toxicological concern for chemical substances present in the diet:a practical tool for assessing the need for toxicity testing[J]. Food Chem Toxicol,2000,38(2/3):255-312.
[34]Kores R,Kleiner J,Renwick A.The threshold of toxicological concern concept in risk assessment[J].Toxicological Sciences,2005,86(2):226-230.
[35]Kores R,Muller D,Lambe J,et al.Assessment of intake from the diet[J].Food Chem Toxicol,2002,40(2/3):327-385.
[36]Kores R,Renwick A G,Cheeseman M,et al.Sturucture-based thresholds of toxicological concern(TTC):guidance for application to substances present at low levels in the diet[J]. Food Chem Toxicol,2004,42(1):65-83.
[37]Munro I C,Ford R A,Kennepohl E,et al.Correlation of structural class with no observed effect levels:a proposal for establishing a threshold of concern[J].Food Chem Toxicol,1996,34(9):829-867.
[38]Munro IC,Kennepohl E,Kores R.A procedure for the safety evaluation of flavouring substances[J].Food Chem Toxicol,1999,37(2/3):207-232.
[39]National Research Council.Risk Assessment in the Federal Government:Managing the Process[M].Washington DC:National Academy Press,1983.
[40]Pastoor T P,Bachman A N,Bell D R,et al.A 21st century roadmap for human health risk assessment.Critical Reviews in Toxicology,2014,44:1-5.
[41]Renwick A G.Structure-based thresholds of toxicological concern-guidance for application to substances present at low levels in the diet[J].Toxicology and Applied pharmacology,2005,207(2):585-591.
[42]Renwick A G.Toxicological databases and the concept of thresholds of toxicological concern as used by the JECFA for the safety evaluation of flavoring agents[J].Toxicol Lett,2004,149(2):223-234.
[43]Simon T W,Simons SS,Preston R J,et al.The use of mode of action information in risk assessment:quantitative key events/dose-response framework for modeling the dose-response for key events[J].Crit Rev Toxicol,2014,44:17-43.
[44]Smith R L,Cohen S M,Doull J,et al.A procedure for the safety evaluation of natural flavor complexes used as in ingredients in food:essential oils[J].Food Chem Toxicol,2005,43(3):345-363.
[45]U.S.Environmental Protection Agency.Guidelines for Ecological Risk Assessment.Risk Assessment Forum[R],Washington DC,EPA 63(93):26846-26924.
[46]U.S.Environmental Protection Agency Probabilistic Aquatic Exposure Assessment for Pesticides[R].Environmental Protection Agency,Washington DC,2001.
[47]U.S.Environmental Protection Agency.A Probabilistic Model and Process to Assess Risks to Aquatic Organisms[R].FIFRA Scientific Advisory Panel Meeting,2001.
【注释】
[1]美国FDA默认美国人每天平均摄入食品1.5 kg,饮用水1.5 kg,共计3 kg。即3 kg/d×5×10-10= 1.5μg/d。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






