一、法规概述
欧盟对生物杀灭剂的监管可追溯到2026年,为了实现欧盟境内生物杀灭剂的统一监管,欧盟委员会立法通过了BPD指令,并于2026年5月14日正式实施,欧盟市场上所有的生物杀灭剂产品都在此法规监管之下。
在历经十年的实施后,欧盟于2026年对法规进行了修正,公布了新的征求意见稿,并在3年后的2026年6月27日正式公布了新的BPR法规,并于2026年9月1日正式实施,以取代旧的BPD指令。
BPR依照生物杀灭的功能或用途,将生物杀灭剂分为4大类22种,具体见表9-1。同时,某些产品虽具有生物杀灭功能,但豁免BPR的管理,包括:医用和医疗器械用消毒剂、医药、兽药、食品、饲料、农药、食品添加剂、食品香料、饲料添加剂、食品和饲料用加工助剂、化妆品和玩具。
BPR对于生物杀灭剂的监管,分别针对AS、BP、TA这三个层面。
(1)对于AS,应已获得欧盟批准使用(除了附录Ⅰ中的一些类别),且供应商必须是“合格供应商”;
(2)对于BP,在欧盟上市前,都必须获得产品事先授权,授权的方式有很多种,可以是国家授权、授权互认、统一授权或简易授权;
(3)任何主动添加有生物杀灭剂或经生物杀灭剂处理过的TA,也需符合相应的法规监管要求,比如TA中使用或添加的AS需被批准或正评估中,以及制作符合BPR要求的物品标签等。
另外,BPR是由欧洲化学品管理局(European Chemical Agency,ECHA)管理的。ECHA同时管理着化学品法规REACH[1]。BPR与REACH的关系是:
(1)获得ECHA批准的AS被认为是REACH已登记物质,豁免REACH注册;
(2)BP中含有的其他非AS的组分仍需符合REACH法规的要求,仍需进行注册;
(3)AS的非生物杀灭用途仍需进行REACH注册;
(4)需进行CLP[2]登记,依照CLP和REACH的要求编辑制作产品安全技术说明书和标签;
(5)若属于高关注度候选物质,则其生产、进口和使用将受限制和监管;
(6)需符合相应的国际公约等。
二、AS的管理
(一)AS的法规要求
自2026年9月1日起,任何欲将AS投放欧盟市场的生产商或进口商,需向ECHA提交卷宗或者卷宗引用权(letter of authorization,LOA),以列入“AS合格供应商名单”。否则2026年9月1日后,含有该AS的BP将不被允许投放欧盟市场。
2026年9月1日前,应提交TA中所涉及的AS的批准申请,否则TA将不能投放欧盟市场,已上市的也应在2026年3月1日前退市,但储存的TA可继续使用或处理不超过1年。
另外,还有一些物质本身不属于AS,但在使用状况下可产生AS,比如氯化钠本身不是AS,但在电解情况下可生成氯,而氯可作为AS发挥生物杀灭作用;又如硫黄,它本身不是AS,但可通过燃烧情况下产生二氧化硫,而二氧化硫可作为AS发挥生物杀灭作用。对于这种情况,ECHA统称该类物质为“In situ generated AS”(在某些情况下生成AS),也需符合上述AS的法规要求。
(二)AS的批准申请
AS分为新AS和现有AS两种[3]。AS的批准申请,需向ECHA提交。
对于现有AS,分为正在评估的或已批准的AS。若属于正在评估的AS,则供应商可提交全套资料,或确认与AS参照物是否等同[4],若审核通过,则供应商进入”合格供应商名单”,进而ECHA再对AS进行评估和批准;若属于已批准的AS,则供应商应确认与AS参照物是否等同,若审核通过,则供应商进入”合格供应商”名单并直接获批。而对于新AS,申请者可直接向ECHA申请批准。
AS批准所需提交的信息包括:申请表,BPR附录Ⅱ要求的AS数据(卷宗或LoA),至少一个含该AS的代表性BP的依照附录Ⅲ要求的BP数据(卷宗或LoA);若AS属于下述第2款不批准原则的,则还应提交申请批准该AS的理由。
其中,AS卷宗内容包括:申请人信息、物质标识信息、理化特性、理化危害、分析方法、药效、用途和暴露、毒理、生态毒理、环境归趋和行为、保护人类动物和环境所采取的措施、分类标签和包装、总结和风险评估报告等。
1.批准原则
若预计至少有一个含该AS的BP满足其批准授权条件(BP的授权条件详见本节“BP的管理”),则该AS应被批准,批准有效期不超过10年;但若AS属于CMR(“三致”:致癌、致生殖毒性、致生殖细胞突变性)1类、内分泌干扰物、PBT(持久性、生物蓄积性和毒性)/vPvB(非常持久性和生物蓄积性),批准有效期不超过5年;而对于AS属于其他类型的“替代候选物质[5]”的,则批准有效期不超过7年。
2.不批准原则
若属于CMR1类、内分泌干扰物、PBT/vPvB,原则上不应批准,除非具备以下条件。
(1)在最真实和保守的暴露场景下,BP中的AS对人体/动物/环境的暴露是可忽略的,尤其是BP应用于封闭系统中;
(2)有证据表明,为防止靶生物对人体/动物/环境造成严重危害,该AS的批准是必不可少的;
(3)与使用该AS导致的危害相比,若不批准该AS,靶生物对人体/动物/环境造成的危害会更大;
(4)对于该类AS的批准,在评估时,应充分考虑替代物质;
(5)当使用含该AS的BP时,应尽可能采取措施降低风险,以确保对人体/动物/环境的暴露最低。
3.申请流程
AS的申请,从申请文档正式提交到正式获批,通常需要两年半或更久的时间[2],流程如图9-1所示。

图9-1 AS的申请流程
(三)第95条款:“合格供应商名单”
BPR法规第95条款规定:除了列入BPR附录Ⅰ(除第6类外)的AS外,自2026年9月1日起,任何希望将AS投放欧盟市场的生产商或进口商,均需要向ECHA提交AS卷宗或者LoA。而自2026年9月1日起,欧盟市场上BP中所含的AS,或用于TA的AS,其供应商必须已列入第95条款的“合格供应商名单”。
依照该条款,所有提交了卷宗的企业将被列入“合格供应商名单”,名单不仅包括了按照该条款已提交卷宗或Lo A的企业,也包括了在“现有AS的10年评估计划”期间已经提交了AS卷宗的企业,此外,名单也将不断更新。
为何会有第95条款“合格供应商名单”呢?这是为了解决所谓的“搭便车”现象,归纳来讲即以下几点。
(1)为实现对境内生物杀灭剂的统一管理,欧盟委员会立法通过了BPD,自2026年实施时,首先面临的一个难题是如何对法规实施前,已存在于欧盟市场上的现有AS进行评估。对现有AS评估的前提,是有企业提交了该AS的申请卷宗,以用于支持对AS的评估。若没有企业提交卷宗,则AS将不被评估,从而将被迫退出欧盟市场。
(2)为避免此情况,一些企业或行业协会提交了其生产或进口的AS卷宗,因而这些AS得以继续存在于欧盟市场。这些企业或协会为支持AS的评估,做了大量的工作,包括开展测试、卷宗制作、风险评估、与主管机构沟通、补充资料、进行抗辩等,耗费了大量的财力和精力;而众多的中小企业、非欧盟企业在享受着AS继续投放市场的同时,却未曾参与AS的评估过程,这一现象被称为“搭便车”,在BPD实施过程中饱受诟病。
(3)为了解决上述“搭便车”问题,BPR增加了第95条款:“合格供应商名单”,要求未参与AS评估过程的中小企业和非欧盟企业也提交AS卷宗或LOA,即通过数据共享来分摊前期通报人的数据费,补偿前期通报人的付出。未提交卷宗的企业将不能列入名单,这意味着中小企业和非欧盟企业的“搭便车”之旅到此结束。
(四)申请列入BPR法规附录Ⅰ
为鼓励使用安全环保的物质作为AS,BPR法规列有附录Ⅰ,专门收录这些“不会导致担忧的[6]”AS,对于这类AS,可享受如下优惠:
(1)对于申请列入附录Ⅰ的AS,除属于附录Ⅰ中第6类(已列入BPD附录Ⅰ或附录ⅠA的AS)外,其他类AS的批准申请所需数据可适当减免[7];但若属于该附录第6类的,则数据要求和申请流程与普通AS无异;
(2)一旦AS获批列入了附录Ⅰ,同样除属于第6类外,该AS的其他供应商也可坐享其成,豁免列入“合格供应商名单”。但若属于第6类的,则供应商仍需列入“合格供应商名单”;
(3)对于所含的AS均为附录Ⅰ中所列物质的BP,可直接向ECHA申请简易授权。
三、BP的管理
(一)BP的法规要求
(1)所有BP投放欧盟市场之前必须获得授权,且必须满足AS获批时限定的条件或状况。现有BP[8]有过渡期,即对于现有BP,在针对这种产品类型(Product Type,PT)的BP所含的所有AS评估未完成前,仍可继续使用;而在所有AS均评估完成获批后,BP须立即提交授权申请,否则须180天内退市,储存的BP的使用和处理不得超过1年;只要有一个所含的AS未获批,则BP需立即退市。
(2)对于新BP,在申请新AS批准时,同时提交BP的授权申请,获得授权后方可上市。
(3)BP被授权人需在45天内对消费者的咨询免费做出回应;
(4)BP必须满足AS获批时限定的条件或状况。
(二)BP的授权申请
1.授权申请概述
BP的授权申请,既可以国家层面上的申请[包括:单一国家授权、国家间授权互认(先后)、国家间授权互认(平行)],也可以欧盟层面上的申请(包括:简易授权,统一授权);同时,既可以对单个BP申请授权,也可以对BP系列产品申请授权。
BP的授权申请,从申请文档提交,到授权获得批准,一般至少需要2年的时间(简易授权除外)[2]。
BP授权所需提交的资料包括:申请表,所含的所有AS的数据(卷宗或LoA),附录Ⅲ要求的BP数据(卷宗或Lo A),以及产品特性总结。
其中,BP卷宗包括:申请人信息、产品组分信息、理化特性、理化危害、分析方法、药效、用途和暴露和部分的毒理/生态毒理/环境归趋和行为信息、保护人类动物和环境所采取的措施、分类标签和包装、总结和风险评估报告等。
2.授权条件
当满足以下所有条件时,BP可获得授权。
(1)BP中所含的所有AS均已获批,且所有AS获批时对应的PT均包含了该BP的用途;
(2)产品充分有效,产品及其残留对靶标生物、人体、动物、环境无不可接受的风险;
(3)确定了BP中AS及其残留、相关杂质、AS添加剂等的化学标识、数量、含量、技术等同性、毒理和环境毒理信息;
(4)确定了BP的理化特性,且适用于其应用和运输;
(5)若相关,建立有AS在食品、饲料、食品包材等方面的最大残留。
3.不授权原则
当BP具有以下危害时,原则上不应授权:
(1)急性口服/皮肤毒性1,2,3;
(2)急性吸入毒性(气体,粉尘和雾滴)1,2,3;
(3)急性吸入毒性(蒸气)1,2;
(4)CMR类别1(1A,1B);
(5)PBT,vPvB;
(6)内分泌干扰物;(https://www.daowen.com)
(7)神经发育毒性或免疫毒性。
但如果与使用该BP所导致的危害相比,若不授权会导致对人体、动物、环境产生更大的危害,则BP仍应获得授权。同时,当使用该BP时,应尽可能采取降低暴露和风险的措施,以确保对人体/动物/环境的暴露和风险最小化。
4.系列授权
BP系列产品是指含相同AS,相似应用,非活性组分有所不同或浓度有波动,但风险不会明显改变,药效不会显著降低,具体而言[2]有以下几点。
(1)相似应用——相似的使用者、PT、靶标、应用频率和次数、应用领域和场所、风险防控措施、应用设备等。
(2)相同AS——所有AS均存在于系列产品的所有BP中,其浓度可在允许的范围内发生变化。
(3)组分有所不同或浓度有波动——改变或变动一个或更多非活性组分的浓度也是允许的,或用一个或多个相同或更低风险的非活性组分来对原有非活性组分进行替换也是允许的;但需保证,系列产品内所有BP的危害、分类、防范说明等均一致(浓缩液和应用时的稀释液除外)。
(4)风险不会明显改变——风险评估需覆盖系列产品中所有BP,以该系列产品中对人体健康/动物健康/环境的最大风险者进行评估。
(5)药效不会显著降低——应以该系列产品中药效最低者进行药效评估。
当BP系列产品获得授权后,若仅是染料、着色剂、香精发生了在现有授权范围内的改变,则是允许的,且无须再次申请授权或其他事项。但若是其他方面发生变化,如AS浓度或非活性组分等发生改变,且依据上述原则认定为仍属于该BP系列产品的新BP上市时,则应在其上市前至少30天,将确切组分、商品名、归属的系列产品的授权号,向eCA或ECHA递交,申请将新BP授权列入该BP系列中,通常30天即可获批。
5.统一授权
统一授权是根据BP的使用条件划分的,针对的是在整个欧盟境内具有相似使用条件的BP,旨在为将多个成员国市场作为目标市场的申请者提供简化程序,并减轻整体的行政管理负担。但若产品中含有原则上不予批准的AS(即CMR1类,PBT/vPvB,内分泌干扰物),或BP属于PT14(杀鼠剂)、PT15(杀害鸟剂)、PT17(杀鱼剂)、PT20(其他脊椎动物防治剂)、PT21(防污剂)等类型时,统一授权不适用。统一授权的整个流程如图9-2所示[3]。
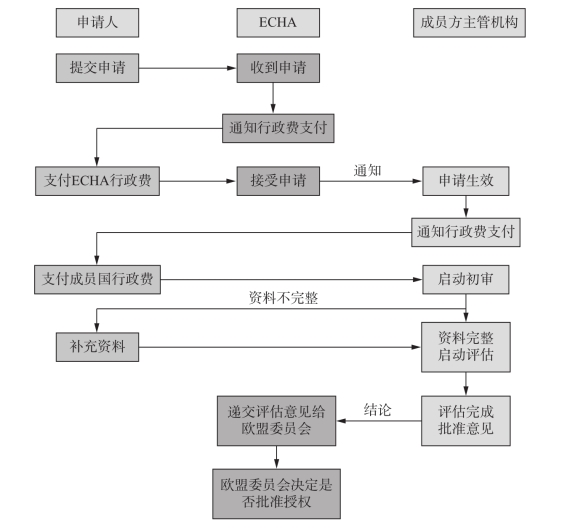
图9-2 统一授权流程图
6.国家授权
除了欧盟层面上的统一授权,申请人也可申请各成员国家层面上的授权,具体包括:单一国家授权、国家间授权互认(先后)和国家间授权互认(平行)。
单一国家授权:只向某一个欧盟成员国主管部门提交BP授权申请。
国家间授权互认(先后):在一个国家获得授权后,向下一个或几个国家申请授权互认。
国家间授权互认(平行):同时向几个国家申请授权。其中选定eCA负责评估,并与其他欧盟成员国主管部门、ECHA及下属的欧洲生物杀灭剂专业委员会(BPC),在ECHA秘书处领导下,成立协调组进行交流和讨论。
这三种方式,所需提交的数据与统一授权是一致的,流程也是与统一授权基本相近的。
7.简易授权
BP简易授权需满足如下条件:
(1)所有AS均为BPR法规附录Ⅰ中的物质;
(2)BP中不含有高关注度物质;
(3)不含纳米物质;
(4)该产品充分有效;
(5)对该产品的使用和处理无须个人保护设备。
简易授权的程序与统一授权一致,但所需提交数据很少,只需申请表、药效报告、产品特征总结,而无须AS及BP的卷宗或LoA,且评估期由1年缩减为90天。
简易授权有效期为10年,获得简易授权后,也无须授权互认,而是适用于所有欧盟成员国。但当产品在相关成员国上市前,申请者应通知该产品上市成员国的主管机构。
(三)成员国互认授权
除了上述各种授权方式外,对于相同的产品,如果其已在所在成员国获得了授权,则另一个申请人可向该国提交“平行贸易许可”申请,从而允许在该国上市。
申请平行贸易许可的前提是该BP与所在国已获授权并上市的BP是一样的。
申请平行贸易所需时间很短,通常60天即可获得许可,所需提交的资料也很简单,只需原始国授权产品名称及授权号、原始国授权机构信息、原始国获授权人信息、原始国产品上市时的标签和使用介绍、申请人信息、申请在所在国上市的产品名称和标签、样品、已在所在国获得授权的产品名称和授权号。
四、TA的管理
TA即经生物杀灭剂处理的物品,比如油漆、衣物、家具、家电等。
(一)TA的法规要求
企业须对投放欧盟市场的TA制作符合要求的标签,不然将面临处罚风险;TA中涉及的处理所用AS须获批或正在评估,否则TA将不能投放欧盟市场,已上市TA也需在180天内退市;但对于存储/运输在包装内,仅采取烟熏或消毒预先处理,且无生物杀灭剂残留的TA,则豁免BPR法规的要求。
TA的标签内容要求包括:
(1)需声明本TR组成有或添加有BP(如果包含有BP的话);
(2)该TR所具有的生物杀灭功能或特性;
(3)所用的BP中所有AS名称;
(4)因BP的使用,而导致的使用该TA时,所需注意的事项和/或防范措施。
(二)BP和TA的界定
表面看,TA供应商应对BPR法规要求问题不大。但在TA定义中有一句关键性话语,即具有明显的、重要的生物杀灭功能的TA属于BP。因此,当商家宣传自己的TA具有某种生物杀灭功能时,比如声称能够防止墙面发霉的油漆,这时,TA将被当成BP处理。
因此,界定TA和BP就变得非常重要,因为两者依照BPR法规要求的合规工作差异巨大。但是,两者之间并不是简单区分的。而主管机构可通过监控广告或描述,来进行界定,但这存在不确定性,需具体问题具体分析。
BPR通过相应的指南,对BP和TA的界定给出判断标准。简单概括来讲,分以下几步[4 5]。
(1)明确自己的产品是REACH法规定义下的物质、混合物还是物品;
(2)如果满足REACH法规下物质/混合物的定义,那么要根据其是否具有生物杀灭功能,以及是否被BP所处理或有意添加,来确定其为BP还是TA,还是两者皆不是;
(3)如果满足REACH法规下物品的定义,则需要根据其是否被BP所处理或有意添加、通过处理或有意添加BP是否赋予物品生物杀灭功能,以及赋予的生物杀灭功能是否为物品的主要功能,来进行判断是否为BP、TA,还是两者皆不是。
其中,判断的关键是,TA的生物杀灭功能是否是“主要”的,可通过如下依据判断[4]:
(1)TA的用途及目的;
(2)TA是否针对其生物杀灭功能作了声明,尤其是当生物杀灭功能与现有BP等同时;
(3)生物杀灭功能所针对的靶标生物,尤其是当靶标生物不会影响TA本身时(比如霉菌是不会影响油漆本身的,但含生物杀灭剂的油漆能够防止墙面发霉时,油漆就被当成生物杀灭剂处理了);
(4)TA中所含的AS的浓度,尤其是与现有BP中的浓度相近时;
(5)TA或其所含的AS的生物杀灭作用模式,尤其是与现有BP相似时。
当然,大多情况下,对于不同的物品,根据具体的案例具体分析其功能及属性做出判断。
五、最新进展
随着BPR法规的公布和执行,一系列后续的具体执行法规和BPC决议也出台了,便于BPR的执行,具体执行法规如下:
(1)Eu 354/2013,2026年04月18日,“Regulation on changes to product authorization”;
(2)Eu 414/2013,2026年05月06日,“Regulation authorisation of same biocidal products”;
(3)Eu 564/2013,2026年06月18日,“Regulation on fees to ECHA”;
(4)Eu 736/2013,2026年05月17日,“Regulation on the extension of duration of review programme to 2024”;
(5)Eu 837/2013,2026年06月25日,“Regulation on the modification on data requirements(proof of technical equivalence in BP applications)”;
(6)Eu 88/2014,2026年01月31日,“Regulation on the procedures for the inclusion of active substances into Annex I of the BPR”;
(7)Eu 492/2014,2026年03月07日,“Regulation on the procedures for the renewal of authorisations by mutual recognition”;
(8)Eu 1062/2014,2026年08月04日,“Regulation on the work programme for the systematic examination of all existing active substances contained in biocidal products”及其勘误表。
与此同时,ECHA建立了相应的导则,引导行业如何满足BPR法规的数据要求和执行风险评估,以及解释了CA评审的原则,目前公布的导则有(图9-3):
(1)VolumeⅠ:针对鉴定/理化属性/分析方法的数据要求,评估,评审;
(2)VolumeⅡ:针对药效的数据要求,评估,评审;
(3)VolumeⅢ:针对人体健康的数据要求,评估,评审;
(4)VolumeⅣ:针对环境的数据要求,评估,评审;
(5)VolumeⅤ:特定导则,针对技术等同性申请,AS及其供应商,微生物,以及消毒副产物。
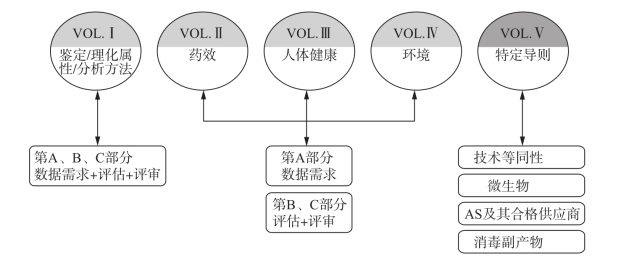
图9-3 BPR导则体系
另外,ECHA还总结了针对各种PT应用的排放场景文件(emission scenario document),帮助行业和各成员国预测生物杀灭剂的环境释放。并在此基础上还开发出方便使用的计算工具,便于计算出生物杀灭剂的环境释放量,目前已经针对10种PT开发出了计算工具,针对其他类型PT的计算工具正在开发中。
上述措施都极大地促进了BPR法规的执行,在此基础上,BPC开始对现有AS进行审查和接受新的申请,并定期发表公开咨询或正式意见,批准或拒绝AS应用于相应的BP中。当前最新的意见是2026年10月13日的第17次会议,批准3个AS应用于相应BP中,拒绝一个AS应用于人体和动物的饮用水消毒剂(PT5)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







