
一、现有药用辅料
1.美国
在美国,药用辅料生产商可以查看美国药典国家处方集(USP-NF)的药用辅料专论,或查看FDA非活性成分数据库(IID)来判断自己生产的药用辅料是否为现有药用辅料,只要是现有药用辅料,其产品质量必须满足USP-NF药用辅料专论为其规定的质量要求。
在美国,药用辅料受《联邦食品药品化妆品法》(FFDCA[9])的监管,按照FFDCA 510(a)(2)(B)小节的规定,药用辅料必须满足药品使用要求,药用辅料的生产、加工和包装必须满足现行药品生产管理规范(cGPM)的要求。但FDA对药用辅料产品没有实行市场准入的许可制度,对药用辅料生产过程是否满足cGMP要求也没有实行认证的机制。但药品生产商在向FDA申请其药品市场准入时,必须提供其药用辅料满足药品使用的证据,即药用辅料的产品特性、生产工艺、质量指标、验证检测方法及安全毒理试验或应用数据信息。
如不涉及商业机密,药用辅料生产商可以将相关资料信息直接提供给药品生产商;如涉及商业机密,药用辅料生产商也可在签署保密协议情形下,将相关资料信息直接提供给FDA,以帮助药品生产商申请其药品的市场准入;但往往相同的药用辅料,其生产工艺不同,其产品特性、质量指标以及安全性能会有很大的差异。所以药用辅料生产商都视其产品特性、生产工艺、质量指标、验证检测方法以及安全毒理试验数据为商业机密。
为保护药用辅料生产商的商业机密,FDA提供了一个自愿备案DMF[10]的机制,即药用辅料生产商将其产品的产品特性、生产工艺、质量指标、验证检测方法以及安全毒理试验或应用数据信息按规定的格式要求递交FDA,经FDA审核符合备案要求的DMF准予备案并发放DMF备案批准号。
当同一药用辅料售予不同药品生产商用于不同药品申请时,只要告知DMF备案批准号,并授权FDA参阅该DMF批准号的数据信息,就可避免重复提交相同的资料信息,大大便利了药品申请和审批的过程。
2.欧洲
在欧洲没有类似美国FDA的非活性成分数据库(IID),药用辅料生产商只能查看PhEur的药用辅料专论或咨询各成员国政府主管部门来判断自己生产的药用辅料是否为现有药用辅料,只要是现有药用辅料,其产品质量必须满足PhEur的药用辅料专论为其规定的质量要求。
按照Directive 2004/27/EC[11]的规定生产下列药用辅料,其生产过程必须进行GMP认证后,方可用作药用辅料,除此之外,欧洲对其他药用辅料的生产没有实行认证的机制。
(1)采用TSE相关动物原料的药用辅料;
(2)采用动物或人体原料存在病毒污染风险的药用辅料;
(3)宣称无菌的药用辅料——其后续使用不需要进一步灭菌的药用辅料;
(4)宣称内毒素/热源受控的药用辅料;
(5)用作药用辅料的丙二醇和甘油。
在欧洲,与FDA的自愿备案DMF机制相类似,药用辅料生产商可以自愿向欧洲药品质量管理局(EDQM)申请药品适用证CEP[12]。
3.日本
在日本药用辅料生产商可以查看Japanese Pharmacopoeia(JP)的药用辅料专论,或查看IPEC和厚生省联合编定的日本药用辅料字典来判断自己生产的药用辅料是否为现有药用辅料,只要是现有药用辅料,其产品质量必须满足JP药用辅料专论为其规定的质量要求。日本对药用辅料的生产也没有实行认证的机制。
二、新药用辅料
在美国凡没有USP-NF药用辅料专论的,且不在FDA非活性成分数据库的使用剂型中出现过的药用辅料就是新药用辅料。使用新药用辅料的药品,其市场准入申请的评审必须按FDA药用辅料安全评价的非临床试验要求指南[13]进行,或根据USP-NF<1074>[14]药用辅料生物安全评价指南进行。新药用辅料安全评价所需递交的数据内容格式必须满足药品通用技术文件(CTD)[15]的要求,CTD具体的要求如下:
①CTD目录;②CTD内容简介;③产品质量总论;④非临床试验概述;⑤临床试验概述;⑥非临床试验总结;⑦临床试验总结;⑧产品质量详论;⑨非临床试验报告;⑩临床试验报告。
USP-NF<1074>既为新药用辅料安全评价提供了科学依据,同时也为药用辅料生产商如何准备资料提供了详细的指南。药用辅料生产商在准备毒理数据前首先必须明确药用辅料的如下信息:
①产品的理化性质;②产品的生产工艺;③产品的质量规格要求(包括杂志、残留信息);④预计暴露条件(暴露途径、剂量、时间及频度);⑤预计适用人群及数量;⑥是否具有药物活性。(www.daowen.com)
在此基础上,药用辅料生产商可以开始准备毒理数据测试,新药用辅料安全评价的具体毒理数据要求见表7-1。
表7-1 新药用辅料安全评价要求
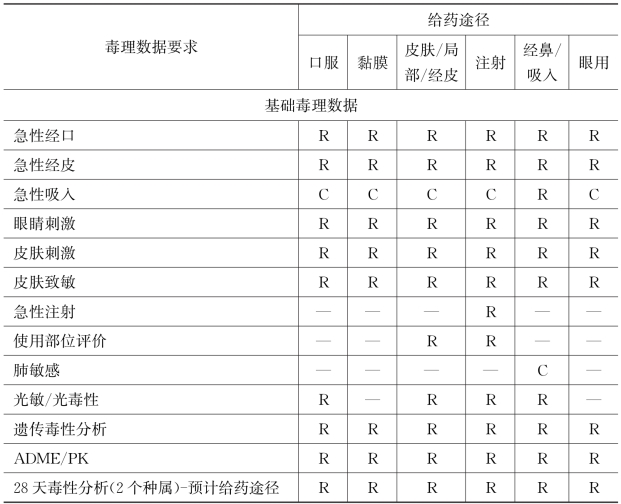
续表
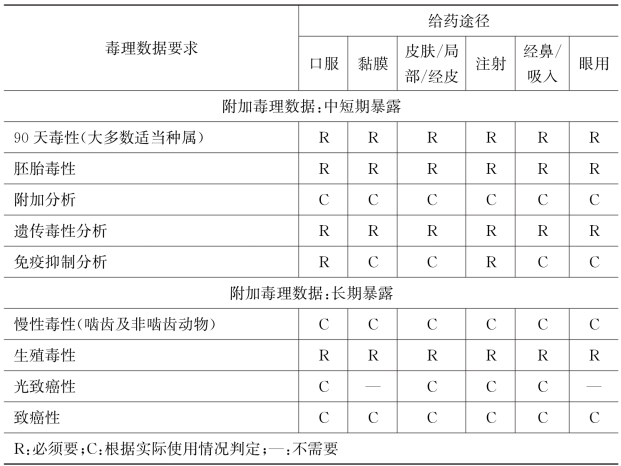
当含有新药用辅料的药品获得FDA批准上市后,新药用辅料生产商可以要求将此新药用辅料登录到USP-NF的专论中,递交登录的信息必须满足药用辅料专论的格式要求。
欧洲药品管理局和日本厚生省对新药用辅料的评价要求与FDA类似,都包含在含有新药用辅料药品的评价中。
参考文献:
[1]US Food&Drug Administration title 21,Section 210.3 definition[EB/OL].https:// www.gpo.gov/fdsys/pkg/CFR-2011-title21-vol4/pdf/CFR-2011-title21-vol4-sec210-3.pdf.
[2]IPEC.Qualification of Excipients for Use in Pharmaceuticals[EB/OL].2008[2016-10-21]. http://ipecamericas.org/sites/default/files/ExcipientQualificationGuide.pdf.
[3]国务院.中华人民共和国药品管理法[Z].2015-04-24.
[4]国家食品药品监督管理总局.药用辅料生产质量管理规范[Z].2006-03-23.
[5]国家食品药品监督管理总局.加强药用辅料监督管理的有关规定[Z].2012-08-01.
[6]国家食品药品监督管理总局.药品生产监督管理办法[Z].2004-08-05.
[7]国家食品药品监督管理总局.药用辅料注册管理办法(试行)[Z].2006
[8]国家食品药品监督管理总局.关于药包材药用辅料与药品关联审评审批有关事项的公告[Z].2016-08-10.
[9]U.S.Congress.The Federal Food Drug and Cosmetic Act[Z].1938.
[10]US Food&Drug Administration.Drug Master Files:Guidelines[EB/OL].http:// www.fda.gov/Drugs/GuidanceComplianceRegulatoryInformation/ Guidances/ucm122886.htm.
[11]European Union.Directive 2004/27/EC on the Community code relating to medicinal products for human use[S].2004-03-31.
[12]Council of Europe.Certification of suitability to the Monographs of the European Pharmacopoeia[EB/OL].https://www.edqm.eu/sites/default/files/guidance_for_esubmissions_foe_cep_applications-november2016.pdf.
[13]US Food&Drug Administration.Guidance for Industry,Nonclinical Studies for the Safety Evaluation of Pharmaceutical Excipients[EB/OL].http://www.fda.gov/ ohrms/dockets/98fr/2002d-0389-gdl0002.pdf.
[14]US Food&Drug Administration.USP-NF〈1074〉Excipient Biological Safety Evaluation Guidelines[EB/OL].http://www.pharmacopeia.cn/v29240/usp29nf24s0_c1074. html.
[15]European Union.Notice to Applicants,Medicinal Products for Human Use,Volume 2B [EB/OL].http://ec.europa.eu/health/sites/health/files/files/eudralex/vol-2/b/update_200805/ctd_05-2008_en.pdf.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







