
(一)台湾化妆品定义及分类
中国台湾地区《化妆品卫生管理条例》将化妆品定义为施于人体外部,以润泽发肤、刺激嗅觉、掩饰体臭或修饰容貌之物品。
其范围及种类由台湾的主管机构“卫生福利部食品药物管理署”进行公告。在《化妆品范围及种类表》中列有15大类:头发用化妆品类、洗发用化妆品类、化妆水类、化妆用油类、香水类、香粉类、面霜乳液类、沐浴用化妆品类、洗脸用化妆品类、粉底类、唇膏类、覆盖用化妆品类、眼部用化妆品类、指甲用化妆品类及香皂类。
根据卫生福利主管部门2016年4月1日公告,自2017年6月1日起,婴儿专用湿巾也纳入化妆品种类管理。
(二)中国台湾化妆品监管
中国台湾化妆品的管理是由卫生福利部下属的食品药物管理署医疗器械化妆品组负责,化妆品的生产由县市级“卫生主管机关”及“工业主管机关”负责监管。
化妆品监管的主要依据是《化妆品卫生管理条例》及其实施细则,食品药物管理署依据《化妆品卫生管理条例》制定了系列法规,并通过公告发布了化妆品禁止使用成分的名录、《化妆品范围及种类表》《法定化妆品色素品目总表》《化妆品中防腐剂成分使用及限量规定》和《化妆品标签仿单包装之标示规定》等。
二、加拿大化妆品和化妆品原料的法规
(一)加拿大化妆品法规概述
加拿大对化妆品的监管依据是《食品药品法案》(Food and Drugs Act),以及在其框架下制定的《化妆品条例》(Cosmetic Regulation)。《食品药品法案》规定了食品、药品、化妆品及医疗器械的基本管理架构和原则,给出了化妆品的定义。《化妆品条例》明确了化妆品具体的管理政策,如包装、标签、安全、备案等。《食品药品法案》制定于1985年,并于2008年进行了最新一次修订。
与化妆品相关的法律法规还包括《消费品包装和标签条例》(Consumer Packaging and Labelling Regulations)、《危险产品法案》(Hazardous Products Act)以及在此框架下的《消费者化学品和容器条例》(Consummer Chemicals and Containers Regulations)。
此外,政府部门和相关协会还出台了很多与化妆品相关的指南及文件,用于指导化妆品的生产、销售及管理。如《化妆品标签》(Labelling of Cosmetics)用于指导相关人员准备符合加拿大化妆品法规要求的标签;《化妆品广告和标签宣传》(Guidelines for Cosmetics Advertising and Labelling Claims)用于指导广告策划者发布符合加拿大化妆品法规要求的广告信息,包括包装及包装内产品的信息;《化妆品成分清单》(Cosmetics Ingredient Hotlist)则罗列了禁止和限制用于化妆品中的成分。
(二)加拿大化妆品定义及分类
根据《食品药品法案》,化妆品的定义是所有为清洁、改善或改变肤色、皮肤、头发或牙齿而生产、销售或展示的任何物质或混合物。这个定义包括除臭剂、香水和香皂,用于动物美容的产品也属于化妆品。加拿大还出台了《介于化妆品和药品之间的产品归类》(Classification of Products at the Cosmetic-Drug Interface)的指导性文件。根据产品的预期使用目的和配方成分,来判定是否属于药品或化妆品。但是加拿大没有专门的一类“医药部外品”的类别。
(三)加拿大化妆品的原料管理
加拿大出台了“化妆品成分清单”,用于规定化妆品中禁止使用和限制使用的成分。该清单会不断更新。当某一成分因安全性问题受到关注时,也会被立即禁止或限制,不需要等到纳入清单。
(四)加拿大化妆品的产品管理
根据《化妆品条例》的规定,部长有权以书面形式要求生产商在指定日期之前,将化妆品的推荐或正常使用条件下的安全性证据提交给部长。
在首次销售某一化妆品10天之内,生产商或进口商需要将一些资料提交给部长,包括通告表、化妆品标签和说明书、产品名称、生产商名称和地址、化妆品的功能、成分表等。
(五)加拿大化妆品标签标识
根据《食品药品法案》和《化妆品条例》,化妆品标签包括内标签和外标签。标签中的信息需要同时使用英语和法语标识(以INCI名称命名的化妆品成分除外)。
化妆品标签中应包含:生产商的名称及主要营业地点;化妆品的通用名或者其功能,用以反映化妆品的特性。关于成分的标识,除了要求列出全成分,并将大于1%浓度的成分按照百分比降序排列;还要求列出产品中添加的植物成分,并按照INCI名称至少说明其属种。不同色系的彩妆产品,可以在使用的所有着色剂前加注“+/-”或“可能含有”字样。对于芳香剂和香料,可以在成分后面标注“香型”和“香气”,以表明将此类成分添加到化妆品中以便产生或掩盖特定的气味或味道。
对于小包装的容器,可以将成分表以货签、胶条或卡片的形式贴在容器或包装上。根据《消费者化学品和容器条例》,对于压力容器,标签上还需要标注危险符号、危险声明等。
此外,《化妆品条例》中还对部分产品采用“显窃启包装”提出了要求。对特殊类型的化妆品标签标识提出了特殊要求,例如,含有对苯二胺或其他煤焦油基底或中间体的染发剂产品,标签中需要加注警告用语和说明性语句;含有防腐剂的汞或汞盐或其衍生物,则标签中需要加注防腐剂的名称及其浓度等。
三、东盟化妆品和化妆品原料的法规
(一)东盟化妆品法规概述
东盟是指东南亚国家联盟(the Association of Southeast Asian Nations,ASEAN),其成员国包括文莱、柬埔寨、印度尼西亚、老挝、马来西亚、缅甸、菲律宾、新加坡、泰国和越南。2003年9月,在第35届东盟经济部长会议期间,签署了《东盟化妆品统一监管计划协议》(Agreement on the ASEAN Harmonized Cosmetics Regulatory Scheme)。该协议包括《东盟化妆品注册批准文件互认协议》(ASEAN Mutual Recognition Arrangement of Product Registration Approvals for Cosmetics)和《东盟化妆品指令》(ASEAN Cosmetic Directive)和7个技术性文件,包括《东盟化妆品定义和化妆品分类示例清单》(ASEAN Definition of Cosmetics and Illustrative List by Category of Cosmetic Products)、《东盟化妆品成分清单和东盟化妆品成分手册》(ASEAN Cosmetic Ingredient Listings and ASEAN Handbook of Cosmetic Ingredient)、《东盟化妆品标签要求》(ASEAN Cosmetic Labeling Requirements)、《东盟化妆品标签宣称导则》(ASEAN Cosmetic Claims Guidelines)、《东盟化妆品注册要求》(ASEAN Cosmetic Product Registration Requirement)、《东盟化妆品进出口要求》(ASEAN Cosmetic Import/Export Requirement)和《东盟化妆品良好生产规范导则》(ASEAN Guidelines for Cosmetic Good Manufacturing Practice)。
《东盟化妆品统一监管计划协议》于2008年正式实施,其目的是加强成员国之间的合作,确保在东盟上市的所有化妆品的安全性、质量以及所声称的功效,通过一致的技术要求、产品注册批准文件的相互认可和采用化妆品指令,消除成员国之间化妆品的质检贸易壁垒。
《东盟化妆品指令》从化妆品的定义和范围、安全要求、成分列表及成分手册、标签说明书要求、产品信息、分析方法、机构设置等方面进行了具体的规定。
东盟化妆品委员会(ASEAN Cosmetic Committee,ACC)由各成员国代表组成,负责协调、审查和监督协议的执行,以及更新技术性文件等。
东盟标准和质量咨询委员会(ASEAN Consultative Committee for Standards and Quality,ACCSQ)和东盟秘书处(ASEAN Secretariat)在协调和监控本协议和指令的实施上提供了支持,并协助ACC处理与此相关的所有事务。
根据《东盟化妆品注册批准文件互认协议》,各成员国应该相互认可由成员国主管机构依据《东盟化妆品注册要求》和《东盟化妆品标签要求》颁发的化妆品注册批准文件。
(二)东盟化妆品定义
根据《东盟化妆品指令》,化妆品是指与人体表面各个部位(皮肤、毛发、指甲、口唇和外生殖器官)或牙齿、口腔黏膜接触的任何物质或制剂,专门或主要用于清洁、增加芳香、改善外观和(或)消除不良体味和(或)保持或维护良好状态。
(三)东盟化妆品监管
1.化妆品原料管理
《东盟化妆品成分清单和东盟化妆品成分手册》主要参照了欧盟的化妆品指令76/768/EEC,包括化妆品禁用和限制使用的成分清单,允许使用的着色剂、防腐剂、紫外吸收剂等。限用物质清单包含物质名称、适用范围、在化妆品中最大允许浓度以及其他限制和要求、在标签上必须印制的使用条件和警示用语。允许使用的着色剂、防腐剂和紫外吸收剂清单中也详细规定了应用范围、限制要求等。
对于紫外吸收剂,泰国还允许使用额外的5种,其具体物质名称和使用浓度见表4-5。
表4-5 东盟化妆品中暂时允许使用的紫外线吸收剂清单
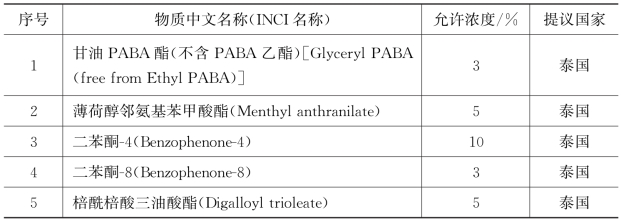
成员国仍然可以批准在其境内使用成分清单中未列出的其他成分。成员国必须对使用批准的物质或制剂生产而成的化妆品实施审查。同时,使用这些成分生产的化妆品必须提供一个明显的标识,表明其在许可范围内,许可有效期为3年。成员国可以在有效期满前通过向ACC申请,将该物质纳入化妆品成分手册中。
化妆品的成分命名可以参考最新版本的国际化妆品成分字典、英国药典、美国药典、化学文摘服务社、日本化妆品成分标准、日本化妆品成分法典等的规定,植物原料及其萃取物应注明其种属,属名可以采用缩略语,但是,原料中的杂质、制备过程中使用、但终产品中并不含有的技术性辅助性原料、严格按照数量要求用作香水或者香味成分的溶剂和载体所使用的原料不应理解为成分。
2.化妆品产品管理
从2008年开始,东盟实行统一的化妆品备案注册制,但是各个国家实际开始实施的日期不同。
根据《东盟化妆品注册要求》,注册是指产品投放市场之前,提交产品资料待审批。根据要求,注册所需时间一般不超过30个工作日。注册的有效期为5年,可以续期。但是如果产品在功效宣称、配方等方面有任何影响产品功能的变更,应重新注册。注册时需要提交产品成分表、成品、试验方法、自由销售证明、良好操作规范证明、原产地证明、特殊功效支持性文件等。各成员国具体要求稍有不同。如马来西亚要求需额外提交备案授权书、美白产品需提交检验报告。泰国要求对含某些特殊成分的产品,提交检验报告。印度尼西亚要求额外提交产品标签或者包装设计稿,并审核产品功效宣传。一些成员国出具的自由销售证明需要大使馆的公证。
对于已经注册批准的产品,根据《东盟化妆品注册批准文件互认协议》的要求,签发国需要向销售国提交通知函和产品注册证明。通知函内容包括产品名称、产品商标、产品描述、产品作用或用途、产品配方(含全成分)并注明限用成分含量、产品经营负责人和地址等。销售国必须在收到文件后的30个自然日内,告知申请人是否批准。
根据《东盟化妆品进出口要求》,进口化妆品需要满足进口国的注册、执照、标签和限用成分的相关要求。进口后直接从东盟国家再出口的产品,可以豁免进口要求。
《东盟化妆品良好操作规范指南》(GMP)作为化妆品生产企业内部质量管理体系的一般指南文件,对化妆品生产过程中的场所、人员、设备、质量控制、文件管理、原材料控制、产品分析、回收制度等环节进行了详细的规定。目前,东盟要求进口产品须提供GMP的符合性证明材料,该证明可以以企业自我承诺的方式出具。
(四)东盟化妆品标签标识(www.daowen.com)
根据《东盟化妆品标签要求》和《东盟化妆品标签宣称导则》,化妆品标签须采用英语及(或)本国语言进行标注,标注内容为化妆品名称和功效、化妆品使用说明、完整的成分清单、生产商所在国家、公司或者责任人的名称和地址、化妆品重量或体积、批号、生产日期或有效期、注意事项、原产国或出厂国的注册号码等。小包装产品需要满足特殊规定的标注要求。
关于注意事项,参照欧盟法规,必须标注欧盟化妆品法规成分列表在“标签上必须印有的注意事项与使用条件”一栏中列明的相关内容。东盟成员国可以按照当地要求给出特定的警示,如公布动物源性成分,可以在产品标签中标注,提取自牛或猪的成分应注明准确的动物种类,提取自人体胎盘的成分也须特别予以注明。
在东盟销售的产品,尤其是进入口腔的产品,需要申请清真许可证(Halal License)。该要求并非政府部门的强制性规定,而是当地穆斯林协会的要求。“Halal”认证的目的是确保产品的配方满足清真的标准和要求,避免动物提取成分,或只含有清真许可的动物成分。清真许可证的认证由指定的机构进行,世界各地都有一些指定的认证机构,如中国的伊斯兰教协会等。清真许可证的申请包括文件审核和生产现场审核两部分。
参考文献:
[1]刘春卉.化妆品质量安全信息指南[M].北京:中国质检出版社,2013.
[2]国家食品药品监督管理总局.化妆品产品生产许可证换(发)证实施细则[EB/OL].CFDA,2007-02-26[2016-12-20].http://www.sda.gov.cn/WS01/CL0846/91756.html.
[3]中华人民共和国卫生部化妆品卫生监督条例.1989-11-13.
[4]中国香料香精化妆品工业协会.第七届理事会工作报告[R].中国香料香精化妆品工业协会,2016.
[5]国家食品药品监督管理总局.关于印发国产非特殊用途化妆品备案管理办法的通知[EB/OL].CFDA,2011-04-21[2016-12-20].http://www.sda.gov.cn/WS01/CL0846/ 60972.html.
[6]国务院办公厅关于印发国家食品药品监督管理总局主要职责内设机构和人员编制规定的通知[EB/OL].国发办,2013-5-15[2016-12-20].http://www.gov.cn/zwgk/2013-05/ 15/content_2403661.htm.
[7]国家食品药品监督管理总局.关于公布国家食品药品监督管理总局化妆品安全专家委员会名单的通知[EB/OL].CFDA,2011-08-25[2016-12-20].http://www.sda.gov.cn/ WS01/CL0846/65072.html.
[8]国家质量监督检验检疫总局.《进出口化妆品检验检疫监督管理办法》(总局令第143号)[EB/OL].2011-8-10[2016-12-20].http://www.aqsiq.gov.cn/xxgk_13386/jlgg_ 12538/zjl/2011/201210/t20121015_235119.htm.
[9]国家食品药品监督管理总局.关于调整化妆品注册备案管理有关事宜的通告[EB/OL]. CFDA,2013-12-16[2016-12-20].http://www.sda.gov.cn/WS01/CL0087/95194.html.
[10]国家食品药品监督管理总局.关于印发化妆品行政许可申报受理规定的通知[EB/ OL].CFDA,2009-12-25[2016-12-20].http://www.sda.gov.cn/WS01/CL0055/ 44671.html.
[11]卫生部.关于印发《国际化妆品原料标准中文名称目录》的通知[EB/OL].2007-09-28 [2016-12-20].http://www.zybh.gov.cn/d?xh=140923.
[12]国家食品药品监督管理总局.关于印发国际化妆品原料标准中文名称目录(2010年版)的通知[EB/OL].CFDA,2010-12-14[2016-12-20].http://www.sda.gov.cn/ WS01/CL0846/57435.html.
[13]国家食品药品监督管理总局.国家食品药品监督管理总局关于发布已使用化妆品原料名称目录的通告[EB/OL].CFDA,2014-6-30[2016-12-20].http://www.sda.gov.cn/ WS01/CL0087/102178.html.
[14]国家食品药品监督管理总局.国家食品药品监督管理总局关于发布化妆品安全技术规范(2015年版)的公告(2015年第268号)[EB/OL].CFDA,2015-12-23[2016-12-20]. http://www.sda.gov.cn/WS01/CL0087/140161.html.
[15]国家食品药品监督管理总局.食品药品监管总局药化注册司公开征求调整植物类化妆品新原料行政许可申报资料要求有关事宜意见[EB/OL].CFDA,2015-11-10[2016-12-20].http://www.sda.gov.cn/WS01/CL0781/134400.html.
[16]国家质量监督检验检疫总局.关于调整从疯牛病疫区进口化妆品管理措施的公告[EB/OL].AQSIQ,2007-7-30[2016-12-20].http://www.aqsiq.gov.cn/xxgk_13386/ jgfl/jckspaqj/zcfg/201210/t20121016_251271.htm.
[17]国家食品药品监督管理总局.总局关于发布防晒化妆品防晒效果标识管理要求的公告(2016年第107号)[EB/OL].CFDA,2016-06-01[2016-12-20].http://www.sda.gov. cn/WS01/CL0087/154562.html.
[18]国家食品药品监督管理总局.关于印发化妆品中可能存在的安全性风险物质风险评估指南的通知(国食药监许[2010]339号)[EB/OL].CFDA,2010-8-23[2016-12-20].http://www.sda.gov.cn/WS01/CL0055/52911.html.
[19]国家食品药品监督管理总局.食品药品监管总局药化注册司公开征求《化妆品安全风险评估指南》意见[EB/OL].CFDA,2015-11-10[2016-12-20].http://www.sda.gov. cn/WS01/CL0781/134401.html.
[20]国家食品药品监督管理总局.关于将化妆品用化学原料体外3T3中性红摄取光毒性试验方法纳入化妆品安全技术规范(2015年版)的通告(2016年第147号)[EB/OL]. CFDA,2016-11-7[2016-12-20].http://www.sda.gov.cn/WS01/CL1870/166246.html.
[21](EU)2016/621 amending Annex VI to Regulation(EC)No 1223/2009 of the European Parliament and of the Council on cosmetic products(ZnO))[EB/OL].http://eurlex.europa.eu/legal-content/EN/TXT/?uri=uriserv:OJ.L_.2016.106.01.0004.01. ENG&toc=OJ:L:2016:106:TOC.
[22](EU)2016/1143 amending Annex VI to Regulation(EC)No 1223/2009 of the European Parliament and of the Council on cosmetic(Titanium Dioxide)[EB/OL].http://eurlex.europa.eu/legal-content/EN/TXT/?uri=uriserv:OJ.L_.2016.189.01.0040.01. ENG&toc=OJ:L:2016:189:TOC.
[23]http://ec.europa.eu/growth/tools-databases/cosing.
[24](EU)Directive 2003/15/EC amending Council Directive 76/768/EEC on the approximation of the laws of the Member States relating to cosmetic products[EB/OL].http:// eur-lex.europa.eu/legal-content/EN/TXT/?qid=1483271328678&uri=CELEX: 32003L0015.
[25]SEC.201.[21 U.S.C.321].
[26]21CFR PART 73 Subpart C&PART 74 Subpart C.http://www.fda.gov/ForIndustry/Color Additives/Color AdditiveInventories/ucm115641.htm.
[27]21 CFR PART 700.11-700.23.http://www.ecfr.gov/cgi-bin/text-idx?c=ecfr&sid= c108128827d21f2d274e894731665ef4&rgn=div6&view=text&node=21:7.0.1.2.10. 2&idno=21.
[28]21 CFR PART 700.27.http://www.ecfr.gov/cgi-bin/text-idx?c=ecfr&sid=c108128827 d21f2d274e894731665ef4&rgn=div6&view=text&node=21:7.0.1.2.10.2&idno= 21#se21.7.700_127.
[29]UA FDA.Nonprescription Sunscreen Drug Product-Safety and effectiveness Data-Guidance for industry.http://www.fda.gov/Drugs/GuidanceComplianceRegulatoryInformation/ Guidances/default.htm.
[30]薬事法等.の一部を改正する法律の概要[R].平成25年法律第84号.
[31]厚生労働省医薬食品局長.医薬部外品等の承認申請について[R].薬食発1121第7号.平成26年11月21日.
[32]厚生労働省医薬食品局審査管理課長.医薬部外品の承認申請に際し留意すべき事項について[R].薬食審査発1121第15号.平成26年11月21日.
[33]厚生労働省医薬食品局長.化粧品等の使用上の注意について[R].薬食発0530第2号.平成26年5月30日.http://www.fda.gov/RegulatoryInformation/Legislation/ FederalFoodDrugandCosmeticActFDCAct/default.htm.
[34]Ministry of Food and Drug Safety.Cosmetics Act.[EB/OL].MFDS,2015-7-29[2016-12-20].http://www.mfds.go.kr/eng/eng/index.do?nMenuCode=167&searchKeyCode= 172&page=2&mode=view&boardSeq=69983.
[35]Ministry of Food and Drug Safety.Enforcement Rule of the Cosmetics Act.[EB/OL]. MFDS.2015-7-29[2016-12-20].http://www.mfds.go.kr/eng/eng/index.do?n Menu-Code=167&search KeyCode=172&page=1&mode=view&boardSeq=70212.
[36]Ministry of Food and Drug Safety.Types,Standards,and Test Methods of Cosmetic Color Additives.[EB/OL].MFDS.2016-3-25[2016-12-20].http://www.mfds.go.kr/eng/ eng/index.do?n MenuCode=167&search KeyCode=172&page=1&mode=view& boardSeq=69996.
[37]Ministry of Food and Drug Safety.Regulations on the Examination of Functional Cosmetics.[EB/OL].MFDS.2015-3-25[2016-12-20].http://www.mfds.go.kr/eng/eng/ index.do?nMenuCode=167&searchKeyCode=172&page=2&mode=view&boardSeq= 69986.
[38]Ministry of Food and Drug Safety.Standards and Test Methods of Functional Cosmetics.[EB/OL].MFDS.2015-3-25[2016-12-20].http://www.mfds.go.kr/eng/eng/index.do?nMenuCode=167&searchKeyCode=172&page=2&mode=view&boardSeq= 69985.
【注释】
[1]依据《化妆品卫生监督条例》(1989年11月13日卫生部令第3号发布)。2015年发布的《化妆品监督管理条例》(征求意见稿)中对化妆品的定义为“是指以涂擦、喷洒或者其他类似方法,散布于人体表面(皮肤、毛发、指甲、口唇等)、牙齿以及口腔黏膜,以清洁、保护、美化、修饰以及保持其处于良好状态为目的的产品”。
[2]依据《化妆品卫生监督条例》(1989年11月13日卫生部令第3号发布)。2015年发布的《化妆品监督管理条例》(征求意见稿)中对化妆品新原料的定义为“是指未列入化妆品已使用原料名称目录的天然或人工原料”。
[3]国家食品药品监督管理总局组织起草了《化妆品用化学原料体外3T3中性红摄取光毒性试验方法》,2016年11月正式发布。该试验方法作为第18项毒理学试验方法纳入《化妆品安全技术规范》(2015年版)第六章。
[4]根据2017年10月27日国家工商行政管理总局令第92号《国家工商行政管理总局关于废止和修改部分规章的决定》,《化妆品广告管理方法》被正式废止。
[5]参见本章本节“美国化妆品和化妆品原料的法规”中的“INCI命名法”
[6]oz=28.350g,1液量oz=28.41m L。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







