(一)欧盟化妆品法规概述
欧盟于1976年实施了《欧盟化妆品指令76/768》(Directive 76/768/EEC)。该指令于2009年11月更新为《欧盟化妆品法规1223/2009》(Regulation 1223/ 2009),并于2013年7月11日起在各个欧盟成员国内实施。该法规规定欧盟成员国的化妆品在上市前不需要卫生主管部门的许可,但是在正常或合理的可预见使用条件下,化妆品不能对人体健康造成损害,尤其是不能基于风险-收益的评估结果来判断对人体健康的危害。制造商或进口商作为责任人需要对其生产的产品安全性负责。一旦发生严重的非预期反应,需要向欧盟国家主管部门尽快通报,保证化妆品的可追溯性。
欧盟层面负责化妆品管理的机构为欧盟委员会(European Commission),负责起草法令。欧盟委员会健康与消费者保护总局(DG SANCO)下设化妆品常务委员会,负责法规的执行并协调各成员国的化妆品事务。欧盟各成员国的主管部门分别负责对其国内上市的产品进行市场监管,这些监管部门成立了欧盟化妆品市场监督部门平台工作组。
(二)欧盟化妆品的定义和分类
根据《欧盟化妆品指令76/768》,化妆品是指用于人体外部任何部位(皮肤、毛发、指甲、口唇和外阴部)或牙齿及口腔黏膜的物质或混合物,主要起到清洁、香化或保护作用,以达到保护良好状况、美容或消除体臭的目的。
与美国化妆品定义不同,用于动物身上的产品不属于化妆品。用于耳朵、鼻子或阴道等黏膜处的产品也不属于化妆品。注射、口服、吸入或植入的产品不属于化妆品。
按照化妆品产品使用方式,可以分为淋洗类和驻留类。欧盟并没有区分普通化妆品和功能性化妆品。
(三)欧盟化妆品的原料管理
《欧盟化妆品法规1223/2009》明确列出了禁用物质清单、限用物质清单和限制使用浓度,允许使用的着色剂、防腐剂、紫外吸收剂、染发剂清单。该清单不定期地进行修订。
根据2001年欧盟化妆品和非食品科学委员会SCCNFP(现改为消费者安全科学委员会SCCS)首次发表的关于致癌性、致突变性和生殖毒性(CMR)物质的官方意见,禁止将CMR一类和二类物质以及具有类似作用的物质(仅具有吸入致癌性的物质除外)有意用于化妆品中。关于三类CMR物质,除非证明其使用浓度水平对消费者健康不具有危害,否则建议和上述处理相同。
根据法规1272/2008/EC附录Ⅵ第3部分的规定,只有经过消费者安全科学委员会SCCS评估、认可后的二类CMR物质才可用于化妆品。对于1A或1B类CMR物质,也需要满足特殊要求才允许使用。该类物质每五年将进行重新评估。
纳米材料是指不溶解或生物降解的并专门生产的一种材料,具有一种或多种外部结构或内部结构,尺寸为1~100nm。根据1223/2009/EEC,含有纳米材料的化妆品应由责任人以电子方式在产品投放市场前6个月上报欧盟委员会,并提交纳米材料的特殊信息,包括鉴定、规格、数量、毒理学特征、暴露量。2016年欧盟批准了纳米氧化锌[21]和纳米二氧化钛[22],并纳入允许使用的防晒剂清单中。在成分表中,如某种成分为纳米材料,需要在该成分后标注“nano”字样。
1996年,SCCS的前身,欧洲美容科学委员会SCC发表意见,指出源于牛、绵羊、山羊脑、脊髓和眼的组织和体液以及源于这些组织的化妆品原料都不得成为化妆品产品的组成成分。此后,该类物质被分为了三类。欧盟化妆品科学委员会SCCP的意见是,一类和二类物质由于其对人体健康的生物性风险,不得用作化妆品组分。鉴于三类物质适用于人食用,因此可用于化妆品组分。
化妆品原料的命名,可以参考国际化妆品成分命名法(INCI)(96/335/ EC)[5]。该目录列出了大量的物质以及这些物质在化妆品成品中可能的功效及对它们的限制。欧盟健康与消费者保护总局(DG SANCO)建立了免费使用的化妆品成分资料库CosIng[23],用于查询INCI名称和一些原料信息。
(四)欧盟化妆品的产品管理
化妆品投放市场前,企业必须将该化妆品的产品信息通过欧盟的化妆品备案门户网站(Cosmetic Products Notification Portal,CPNP)予以备案。产品负责企业必须随时准备供监管机构检查所用的全套文件并定期更新。每个上市产品的标签上要注明其名称和地址。产品信息文件(Product Information File,PIF)应在最后一批化妆品投放市场后保存10年。产品信息文件内容包括化妆品描述、安全性报告、生产方法、化妆品功效性文件等。信息的存放地点可以在产品标签上有所显示。
《欧盟化妆品法规1223/2009》还规定欧盟化妆品生产企业对化妆品的生产工艺需满足良好生产规范(GMP),并对产品上市后的非预期反应进行监测。
(五)欧盟化妆品的产品安全评价
1977年,“美容科学委员会(Scientific Committee on Cosmetology,SCC)”成立,于1997年更名为“化妆品和非食品科学委员会(Scientific Committee on Cosmetic Product and Non-Food Product intended for Consumers,SCCNFP)”。2004年,被“消费品科学委员会(Scientific Committee on Consumer Product,SCCP)”取代。2008年再次更名为消费品安全科学委员会(Scientific Committee on Consumer Safety,SCCS)。
目前,SCC、SCCNFP、SCCP及现在的SCCS已经提出了一系列化妆品安全性评价测试指南,已经被正式接受的有《化妆品原料毒性测试指南》(1982年6月28日,欧盟报告8794)和《化妆品原料安全性评价测试指南》以及多次修订版本。欧盟通过控制化妆品的原料、化学结构、毒性和暴露模式来保证化妆品使用的安全性。
化妆品在投放市场之前,企业需对产品进行安全性评估,完成化妆品产品安全报告(Cosmetic Product Safety Report,CPSR)。此安全性评估由专业人员进行,需考虑到化妆品的预期用途和最终暴露。可以使用合适的权重法(Weight of Evidence,WoE)审核所有来源的数据。随着产品信息的不断增多,产品的安全性报告应随时更新。
安全性评估报告内容包括:化妆品的定量和定性组成、物理和化学特性及稳定性、微生物控制、杂质、痕量禁用物质、包装材料、暴露信息、非预期反应等,以及由这些安全性数据进行评估得出的结论。
法规1223/2009附录Ⅱ、Ⅲ、Ⅳ、Ⅵ、Ⅶ中所列物质属于SCCS的责任范围。附录以外的所有化妆品原料都属于生产商的责任范围,需经过安全评估。
欧盟各个成员国毒物控制中心负责提供与人体健康相关产品的信息,特别是人体健康受损时的救助信息,如产品或毒物相关的鉴定、诊断、紧急处理的专业技术信息,并受企业委托,接受消费者对有关产品的投诉。
(六)欧盟化妆品的标签标识和宣称
根据《欧盟化妆品法规1223/2009》,化妆品标签上需要标注责任人的名字或注册名称和地址、净含量、保质期、使用时注意事项、产品批号或识别码、产品功能的简单描述、全成分清单等。
要求提供全部原料成分标识。当存在可能引起过敏反应的26种香料成分并超过法规限值(驻留类是0.001%,淋洗类是0.01%)时,要求将该致敏原的名字标注在产品标签上。
对于质量小于1/4/oz或体积少于1/8液量oz[6]的小包装化妆品,只需要标注制造商的名称和地址及任何要求的警告声明。
欧盟《委员会法规655/2013》对化妆品宣称进行了相关规定。
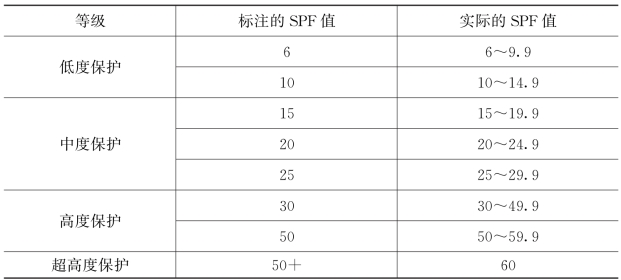
欧盟规定,防晒产品标注必须在包装的正面,应标明SPF值和/或PA值,标注使用说明和应使用的量。不允许防晒产品上标注可100%阻挡紫外线辐射和无须重复使用防晒用品的声明。同时还应提供忠告,标注诸如“即便使用防晒用品,也不要在阳光下长时间停留”“婴幼儿应避免阳光直晒”以及“过度曝晒严重威胁健康”等提醒用语。
表4-3 欧盟防晒产品保护等级
(七)欧盟的动物福利
2003年,欧盟化妆品76/768/EEC指令第七次修订时[24],给出了动物替代实验的时间表,要求自2009年3月11日起,禁止对化妆品的成品进行动物实验。关于重复剂量毒性、生殖毒性和毒物代谢动力学实验等未找到合适的替代方法的实验,实施期限延长至2013年3月11日。虽然替代实验是最终目标,但力求做到减少动物使用量和通过改善方法来减少动物的痛苦和压力。在替代实验中,已经验证的急性毒性替代方法有固定剂量程序法、上下增减剂量法等。已经验证的皮肤刺激实验体外方法有EpiSkin模型实验、EpiDerm模型实验等。已验证的眼刺激替代实验有牛角膜浑浊和渗透性实验(BCOP)、离体兔眼实验(IRE)等。
欧洲替代方法验证中心(ECVAM)负责研究和验证动物性实验的替代方法。经济合作和发展组织(OECD)负责收集和发布包括非动物替代方法等操作指南及规范。
二、美国化妆品和化妆品原料的法规
(一)美国化妆品法规概述
1938年《联邦食品、药品和化妆品法》(FD&C法案)出台,首次对化妆品监管做出规范。
美国化妆品的主管机构是美国食品药品管理局(Food and Drug Administration,FDA),隶属于美国卫生与公众服务部。FDA下属食品安全与应用营养学中心(CFSAN)负责化妆品的安全性和标注的管理。联邦贸易委员会(FTC)主要负责化妆品的广告管理,对不正当和欺诈性行为的管制。
(二)美国化妆品定义及分类
美国《联邦食品、药品和化妆品法》定义化妆品为预计以涂抹、喷洒、喷雾或其他方式使用于人体,能起到清洁、美化、增进或改变外观目的的物品(含有碱性脂肪酸盐且未宣称清洁之外功能的肥皂除外)[25]。
美国化妆品范围较为宽泛,在FDA官方网站上,列举了化妆品自愿注册产品分类目录清单:护肤类、芳香类、眼部及眼部外修饰物、头发护理类、除臭类、面部修饰剂、婴儿用产品、沐浴液、口腔清洁剂、防晒制品等。一些产品在美国作为非处方OTC药物管理,需符合OTC专论的要求,如防晒产品、止汗剂、去屑产品等。化妆品如果宣传具有治疗性,那么它既是化妆品又是药品,即化妆品-药品。在OTC药物专论中没有提到的药品,就属于新药(New Drug Application,NDA),需要通过新药申请程序审批。
(三)美国化妆品的原料管理
1.色素添加剂管理
1960年的《色素添加剂修正案》要求业界提供保证每种着色剂安全的科学根据,食品药品管理局(FDA)由此可以确定着色剂在产品里的纯度限制。另外,FDA有权决定哪些色素添加剂必须经过事前验证是否达到规定纯度标准(即每批色素的样品在使用之前必须被送往FDA进行分析和鉴定)以及哪些色素添加剂的使用无须经过事前验证。对于每种可以使用的色素添加剂,21CFR PART 73 Subpart C[26]详细说明了免于事前验证的色素需要满足的规格、使用条件、标签标注等。21CFR PART 74 Subpart C[26]详细说明了需要事前验证的色素需要满足的规格、使用条件、标签标注等。
色素添加剂的清单由FDA下属的食品安全与应用营养学中心(CFSAN)制定和审查,分为永久性列入的色素和暂时性列入的色素。对于被永久列入的色素添加剂,事先需经过CFSAN的审查以确保对于其预期用途而言是安全的。对于被暂时列入的色素添加剂,CFSAN基于已有数据来确定是否将它们归类于永久列入的色素。出于安全的考虑,FDA也会从清单中剔除部分色素添加剂。例如,FD&C苏丹红1号已经被终止,是基于它对动物肝脏造成的损害。
新的色素添加剂只有经过FDA审核,才可以添加到允许使用清单上。新的色素添加剂的使用申请报告包括:产品特性、物化性质、产品规格和检验方法、生产工艺、稳定性数据、杂质信息、安全性资料、建议的使用目的和限量、允许和限制使用的部位。(www.daowen.com)
色淀是通过吸收和沉淀水溶性染色剂到不溶的无机底物上而成的色素。21CFR提供了适用于化妆品的色淀底物的清单和规格,包括氧化铝、硫酸钡粉、光泽白、黏土、二氧化钛、氧化锌、滑石粉、松香、苯甲酸铝、碳酸钙,或者任何两个或者更多这些成分的组合。
2.禁限用物质
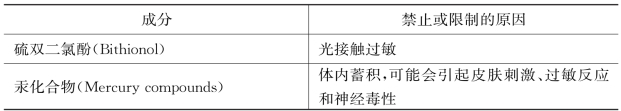
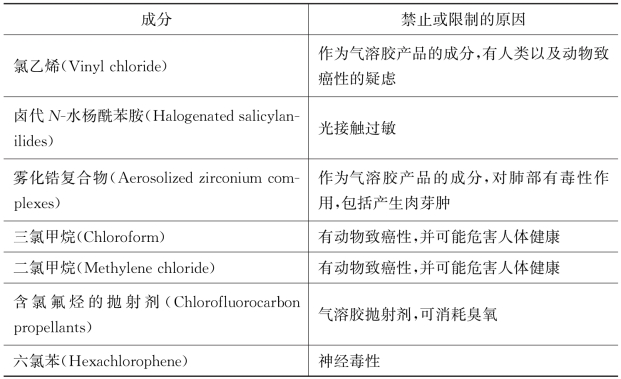
《联邦规章法典》(CFR)禁止在化妆品中使用为数不多的几种成分,包括硫双二氯酚、汞化合物、氯乙烯等。21CFR700.11-23[27]规定,0.1%以下的六氯苯可被用作化妆品中的防腐剂在皮肤上外用,但不允许用于黏膜上,如唇部。汞可以作为防腐剂用于仅限眼部使用的化妆品中,含量少于0.006 5%。
表4-4 禁止或限制在化妆品中使用的成分
续表
3.INCI命名法
美国个人护理用品协会(PCPC)的前身为美国化妆品、洗涤用品和香水协会(Cosmetic,Toiletry And Fragrance Association,CTFA),CTFA于1973年出版了一本《国际化妆品原料字典和手册》,该手册经过多年的不断更新,列出了数以万计的化妆品原料成分,涉及成分的结构、功能和命名等方面的有用信息,但并不涉及成分的安全性评价。1993年,原CTFA命名法改为国际化妆品原料命名法(International Nomenelature of Cosmetic Ingredient,INCI命名法)。目前,该手册命名的化妆品原料的名称已经被多个国家和地区接受并使用。只要原料供应商认为该原料可以用于化妆品生产,就可以向CTFA申请登记该原料信息,并获得INCI名。
4.部分州的地方管理
美国各个州可以制定各自的管理办法。例如,美国明尼苏达州州长Mark Dayton于2014年5月16日签署了SF 2192号法案,该法案对部分铅、汞制品进行了禁止和管制,修正了若干限制部分儿童制品中甲醛使用的条款,并禁止了含三氯生清洁制品的销售。美国加州众议院批准了关于含微珠个人护理产品销售的禁令,该禁令将于2019年1月1日起生效。美国缅因州2014年6月30日立法添加镉、汞和砷进入重点有毒化学品名单。
5.疯牛病
根据21CFR700.27[28]的规定,FDA要求化妆品的制造、加工处理中不得使用禁用牛源性原料,也不得含有禁用牛源性原料。禁用牛源性原料是指高风险原料、牛小肠、来自丧失行走能力的牛原料、来自未检验通过的牛或机械分离的牛肉原料。但允许使用来源于可食用的健康牛的去除了特别危险成分的牛脂,或允许使用那些蛋白质成分在一定水平(不大于0.15%的不溶于水的己烷杂质)以下的牛脂,或牛脂衍生物。牛脂衍生物是从初始水解、皂化或转酯基化中得到化学物质。
PCPC受FDA的委托,可以出具正式的证书,供产品出口时其他国家要求所用。
(四)美国化妆品的产品管理
1.产品管理
在美国,没有针对化妆品产品的事前注册许可程序,FDA也不对化妆品的有效性和安全性或者标签进行事先审批。生产者对其化妆品的安全性、产品成分及产品与规章的符合性负责。
按照21CFR710.1的要求,从事化妆品生产或包装的企业所有人或经营人,都应要求对所属的每个化妆品生产或包装企业进行注册,获得一个永久注册号。但此注册并不代表FDA对该企业的批准和安全性的保障。
2.GMP要求
在法规中没有针对化妆品的良好生产操作规范(GMP)。PCPC《消费者承诺规范》通过声明化妆品的生产应遵循GMP来保证化妆品的质量。化妆品-药品需要遵循药品GMP来生产。
根据21CFR710,化妆品制造商可以自愿对涉及生产或包装销售的化妆品生产设施予以注册。
根据21CFR720,化妆品制造商可以自愿在新产品首次进入市场后六十天内将产品说明报告提交给FDA,停止出售或生产的产品也应向FDA报告。
3.儿童产品
儿童产品是指主要设计或者意图供12周岁及以下儿童使用的消费品。根据消费品安全委员会(CPSC)公布的消费品安全改进法(CPSIA)要求儿童产品满足有关铅含量的产品安全标准。儿童产品应当由一个CPSC接受的实验室来进行符合性测试,必须具备书面证明以确定产品符合法案,还必须有一个牢固粘贴的溯源标签。化妆品在CPSIA中属于豁免产品类别,但是如果是玩具化妆品中的玩具部分,需要满足该法案要求。
4.防晒产品
2011年美国FDA对OTC防晒产品的标签及测试规定做出重大变更。规定防晒产品必须同时提供紫外线(UVB和UVA)保护才能划分为“全效性”或“防止晒伤”。FDA对OTC防晒产品规定也适用于标有防晒指数(SPF)值的化妆品和护肤品。防晒产品标签引导消费者“大量”涂抹防晒产品,并频繁地反复涂抹(至少每两个小时一次)以“防止其效力的降低”。对于防水宣称的产品,需要根据标准的测试,使用者在游泳或出汗时,可以保持40分钟或80分钟有效,才能够宣称“防水”。对于所有的防晒产品,都需要在产品标签中加注警告声明:“暴露在太阳的紫外线下会增加患皮肤癌、早期皮肤老化和其他的皮肤损伤的风险。减少日晒时间、穿防护服以及使用防晒产品是减少紫外线暴露的重要手段”。按照法规的规定,防晒指数的标注值为2~50+。
2016年11月22日,美国FDA发布了《非处方防晒药品——安全性和功效性数据——行业指南》[29],指出了非处方防晒产品活性成分被认为是“总体认为安全和有效成分”(Generally Recognized As Safe and Effective,GRASE)所需安全和功效性的资料要求。该资料还包含可能与其他活性或非活性成分结合后产生的安全与功效数据。在活性成分不稳定的情况下,与光稳定剂结合后的安全与功效数据。值得注意的是,该指南中还提到了防晒产品中活性成分被人体吸收带来的影响。皮肤对活性成分的吸收度也将作为防晒产品新原料的审评点。
5.产品召回
企业可以自愿提交化妆品产品的成分声明,注明产品名称、类型、成分等信息。以及向毒物控制中心提供针对该成分的适当的诊断和治疗流程,以便毒物控制中心能对意外摄入化妆品的事故或其他相关的意外使用事故进行迅速评估和治疗。
FDA对产品召回进行了分类,此分类反映出违规产品与人类健康危害的相关程度。
第一类产品召回是针对那些出售后极有可能对人们的健康产生严重危害的产品,如可能引起严重的不良反应,甚至是死亡。在第一类产品召回中,通常是须将产品从消费者那里回收,并且在大众新闻媒体上发布公告,如报纸,通知消费者这种产品的潜在健康风险。第二类产品召回是针对可能产生暂时的或医学上可逆的健康不良反应,或者不太可能对人们健康产生危害的产品。在第二类产品召回中,产品回收只要求到零售点。第三类产品召回是针对不太可能对人们健康产生任何不良后果的不符合规定的产品,在这种情况下,产品回收只要求涉及批发商。
FD&C法案没有授予FDA直接召回产品的权利,当发现市售产品有缺陷时,只能跟企业进行协商,建议企业自愿召回,否则只能提前进行法律诉讼。
(五)美国化妆品安全性评估
对于化妆品原料成分,其安全性由化妆品原料评价委员会(Cosmetic Ingre-dient Review,CIR)来管理。CIR成立于1976年,由来自FDA、PCPC、化妆品厂家、消费者的代表组成CIR专家小组,负责评价化妆品原料在人体的使用是否安全。最终的安全性评价报告发表在《国际毒理学杂志》上。该安全性报告会对所评价的化妆品原料给予以下五种结论中的一种。
(1)可安全使用原料:原料在目前化妆品中使用的浓度下安全。
(2)在一定使用条件下安全的原料:原料在一定的使用条件下,如一定的浓度、某类别的产品如淋洗产品而不是驻留产品,或其他条件下可安全使用。
(3)安全资料不足的原料:没有特定的资料来证明可以安全使用该原料。
(4)安全资料不足,但未使用的原料。
(5)不安全的原料:已有不良反应资料证明原料在化妆品中使用不安全。
但是,CIR将一些原料排除在评价之外,例如着色剂、OTC药物的有效成分、食品香料、总体认为安全(GRAS)的食品添加剂等,该部分原料由美国FDA来完成评价。香水原料由美国香料研究所(RIFM)来进行评价,也被排除在CIR评价之外。
对于化妆品终产品,其安全性评价由产品制造商负责。采用风险评估的常用方法,包括危害识别、风险特征、暴露评价以及风险控制。
FDA的食品安全与应用营养学中心建立了一个自愿性的不良反应报告系统,作为监控工具用于鉴别可能与市场上食品、膳食补充剂和化妆品有关的潜在的公共健康问题。这个系统叫作CAERS(CFSAN Adverse Events Reporting System)。FDA把它视为一个关键工具,用于鉴别新出现的食品和化妆品的公共健康问题、不良反应模式和趋势。如果FDA接到与某公司产品相关的伤害报告,它将会通知相关公司,并将这一报告输入CAERS数据库中。但是该行为并非强制性。
2007年,PCPC引入了《消费者承诺规范》(Consumer Commitment Code),要求企业自愿上报严重的化妆品不良反应。
(六)美国化妆品标签标识
《商品包装和标签法》规定了化妆品标签标识,包括《化妆品标签》(21CFR701)、《化妆品标签指南》《化妆品警告声明》和《非处方药品(OTC)标签要求》(21CFR201.66)。根据以上法规要求,化妆品标签需要标注产品名称和描述、生产商、包装商或发行商的名称和地址、净含量、全成分表、保质期、生产批号、警告声明等。21CFR701还对文字大小、格式、语言、成分标注、位置等提出了要求。如某些功效性宣称厂商没有数据证明,需要在标签上标明“产品安全性未经证明”。对于通过煤焦油衍生物形成的染发剂产品,需在标签上标注“注意:此产品含有某种对某些人可引起皮肤刺激的成分,因此首先应根据附带的说明进行预先的试验。此产品不可用于眼睫毛或眉毛的染色,否则可致盲”。
除此以外,美国商务部要求进口商品标注原产国,烟、酒、枪炮及爆炸物管理局(ATF)要求对含酒精产品标注变性酒精,以及FDA非处方药专论和药品法规要求对既是化妆品又是药品的产品进行药物标识说明。
对于产品成分,供专业人士使用的产品上可以不列出成分清单。如果愿意,可以通过标签、附带卡片、小册子或其他标签形式提供有关产品成分的信息。产品配方中含量大于1%的化妆品成分应按照降序排列标示出来,含量小于1%的成分可以按任意顺序列出。色素添加剂可以在其他成分之后列出。香料和香精的具体成分可以不必列出。加工过程中使用的辅料和在产品中没有任何技术目的或作用的成分可不必列出。出于商业保密需要,经FDA批准豁免公布的成分可以不列在标签上,但必须于标签组分的最后部分声明“以及其他成分”。对于非处方药,根据《非处方药品(OTC)标签要求》,还必须额外标注“drug facts”,成分表中需要列出活性成分。小包装产品标签也有其相应的豁免条件。成分的命名可以参考PCPC出版的《化妆品原料国际命名词典》,还可以参考《美国药典》《国家处方集》《食品化学法典》《美国采用药名》和《USP药名词典》。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







