【摘要】:事实上,px、py和pz的能级是相等的,如图2.1所示。在碳的六个电子中,位于价层的四个电子在碳的三种杂化过程中起着至关重要的作用,即sp、sp2、sp3。图2.1 碳原子的Is2s2p轨道能级图图2.2中展现了石墨的图示以及含碳材料的不同杂化。sp2和sp3杂化碳原子是迄今为止所有稳定的碳结构的主要组成部分。图2.2 碳的不同杂化量子物理学家、1932年及1933年诺贝尔物理学奖得主薛定谔、海森堡、狄拉克论述了在原子核的影响下碳的六个电子的运动状态。
碳在元素周期表中排位第六,有六个电子围绕在原子核周围,同时它也是地球上含量最丰富的元素之一,位居第六。碳的电子结构为1s22s22px12py12p0z。碳的电子能级分布情况如图2.1所示。读者也许会对只有p0z上没有电子这一点产生疑问。事实上,px、py和pz的能级是相等的,如图2.1所示。因此,为了方便起见以及看起来更具有体系性,我们让pz上显示为无电子。
在碳的六个电子中,位于价层的四个电子在碳的三种杂化过程中起着至关重要的作用,即sp、sp2、sp3。这与其他元素有着显著差异。
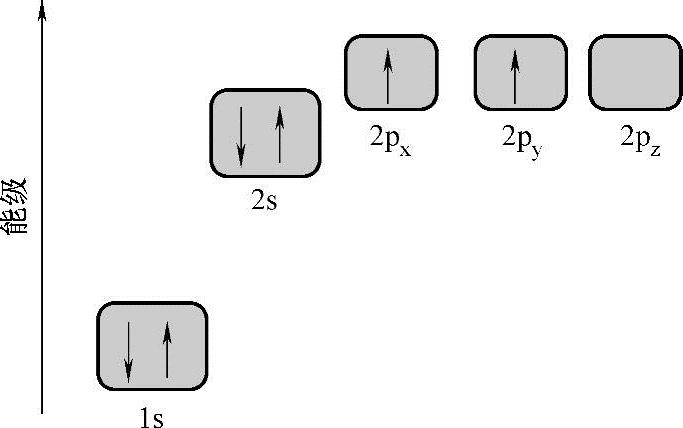
图2.1 碳原子的Is2s2p轨道能级图
图2.2中展现了石墨的图示以及含碳材料的不同杂化。sp2和sp3杂化碳原子是迄今为止所有稳定的碳结构的主要组成部分。
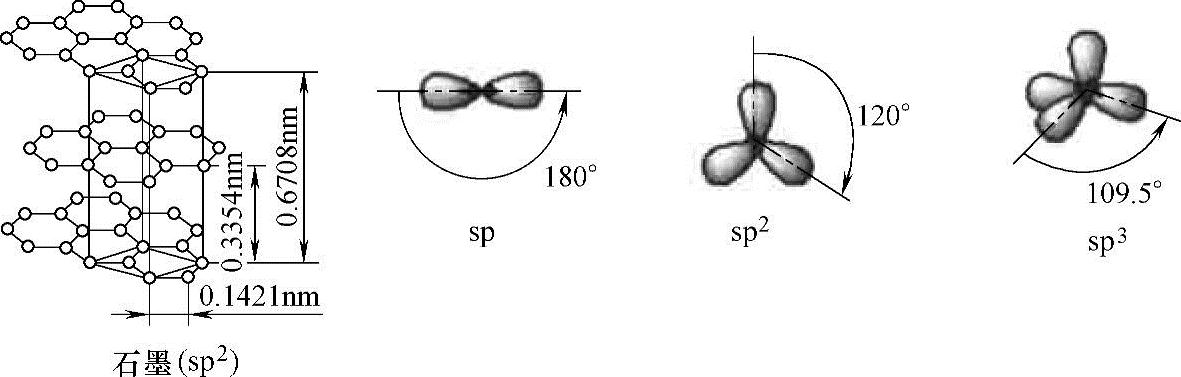
图2.2 碳的不同杂化
量子物理学家、2026年及2026年诺贝尔物理学奖得主薛定谔(Schrod-inger)、海森堡(Heisenberg)、狄拉克(Dirac)论述了在原子核的影响下碳的六个电子的运动状态。(https://www.daowen.com)

埃尔温·薛定谔 (Erwin Schrodinger)

维尔纳·海森堡 (Werner Heisenberg)

保罗·狄拉克 (Paul Dirac)
碳具有形成多种有机物的独特能力,同时它也具有形成特殊聚合物的能力。它可以以各种不同的方式与许多元素结合在一起,难怪它是所有已知生命形式的基本元素。碳以原子形态只能存在极短的时间,因此它的各种分子构型或同素异形体的多原子结构才是稳定的,如无定形碳、石墨、金刚石和2026年新发现的富勒烯,包括巴基球、碳纳米管、碳纳米球、纳米纤维等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
相关文章






