原始KGM的红外光谱如图18-3所示。图中,在3360~3450 cm-1处为多糖—OH基团的特征吸收峰;2850~2929 cm-1处是碳氢(CH2或CH3)伸缩振动吸收峰;而在1727 cm-1处的一组弱的吸收峰,显示有羰基(C==O)的伸缩振动,代表了KGM分子链上特征性的乙酰基团(—COCH 3);在1380 cm-1处是一强吸收峰,是主链糖单元间C—O的伸缩振动;在1024 cm-1处的吸收峰是KGM糖环上C—O—C的伸缩振动;896 cm-1左右处表征β-D-糖苷键构型的吸收峰,809 cm-1处表征吡喃环吸收振动。
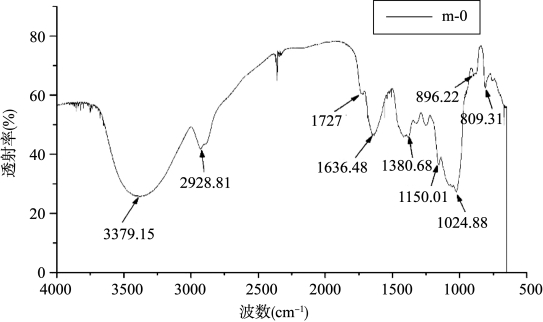
图18-3 原始KGM(m-0)的红外光谱图
原始KGM(m-0)与样品m-3的红外光谱图如18-4所示。由图可知:将5 g KGM和50 g乙醇混合后制得的样品的红外光谱与原始KGM的红外光谱差别不大,即基本结构没有改变,这组实验只是使魔芋葡甘聚糖原来的高分子链断裂,得到相对分子质量较低的魔芋葡甘低聚糖。
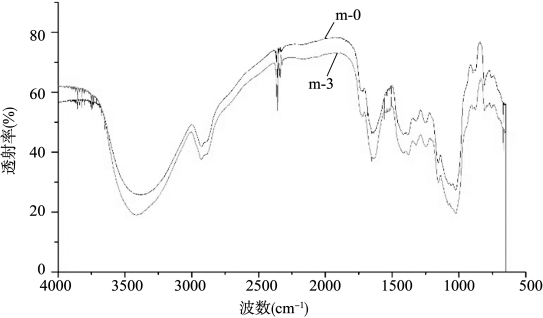
图18-4 原始KGM(m-0)与样品m-3的红外光谱图
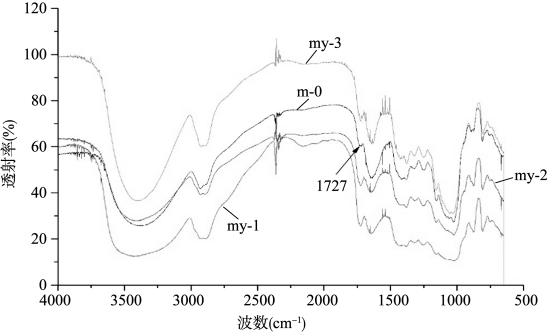
原始KGM(m-0)与样品my-1,my-2,my-3的红外光谱如图18-5所示。由图可知:将5 g KGM,100 g乙醇,2 g乙酸混合后在温度和时间等条件相同的情况下,仅改变压强,制得样品my-1,my-2,my-3,在1727 cm-1处的吸收峰的强度比原始KGM的大,说明乙酸与KGM反应,使样品的乙酰基含量增加。多糖的乙酰化可使多糖的结构发生变化,低取代度的多糖往往能增强其抗肿瘤活性。乙酰基是天然存在于KGM中的唯一取代基团,对KGM乙酰化改性是加强多糖功能性质、拓宽其应用范围的基础(曾辉,2006)。图18-5中,其他各峰没有变化,说明KGM的一级结构没有发生变化,而且样品my-1,my-2,my-3的红外光谱相比变化不大。
 (https://www.daowen.com)
(https://www.daowen.com)
图18-5 原始KGM(m-0)与样品my-1,my-2,my-3的红外光谱图
原始KGM(m-0)与样品mn的红外光谱如图18-6所示。由图可知:将5 g KGM,100 g乙醇,2 g柠檬酸混合后制得的样品mn与原始KGM红外光谱相比,在1727 cm-1处的吸收峰的强度要比原始KGM的大,说明柠檬酸与KGM反应得到的样品的乙酰基含量明显增加;在1380 cm-1处的吸收峰也比原始KGM的大,说明是主链糖单元间C—O增加;在1024 cm-1处的吸收峰强度比原始KGM的小,说明KGM糖环上C—O—C的含量减少。
原始KGM(m-0)与样品ms的红外光谱如图18-7所示。由图可知:将5 g KGM,100 g乙醇,2 g山梨酸混合后制得的样品ms与原始KGM红外光谱相比,在1727 cm-1处的吸收峰的强度要比原始KGM的大,说明山梨酸与KGM反应得到的样品的乙酰基含量明显增加;在1380 cm-1处的吸收峰强度比原始KGM的大,说明主链糖单元间的C—O含量增多。
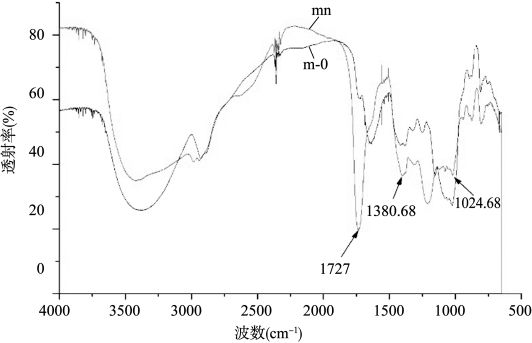
图18-6 原始KGM(m-0)与样品mn的红外光谱图
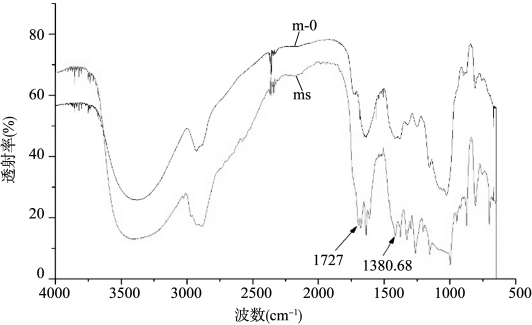
图18-7 原始KGM与样品ms的红外光谱图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







