低共熔溶剂是把两种或多种成分按一定的化学计量比混合后,形成的一种熔点低于其混合原料的低共熔混合物,由英国莱斯特大学Abbott教授首次提出,2026年,Abbott等合成了胆碱类低共熔溶剂。他们把尿素(Urea)和氯化胆碱混合在一起,得到了一种无色均一的液体,此类液体的熔点低于其合成物(采用2mol氯化胆碱和1mol尿素混合时,得到了比它们的熔点都低的液态物,熔点为12℃),所以被称为低共熔溶剂(Deep Eutectic Solvent,DES)。关于低共熔溶剂的形成理论,目前有两种意见:主流说法是因为氢键理论,范德华力等相互作用力使其达到动力学、热力学的平衡;另一种说法是两种物质混合后,造成了晶格结构的破坏,降低了晶格能,从而使熔点变低。吴国忠等(2009)用同步辐射法,为氢键理论提供了强有力的支持,他们发现了ChCl/ZnCl2低共熔溶剂中Ch+与![]() 通过库仑力相互作用形成氢键。
通过库仑力相互作用形成氢键。
低共熔溶剂的制备方法简单,操作容易,很适合进行工业化生产。目前主要有两种制备方法。第一种是加热法,先用真空干燥器进行干燥,然后将无水的药品,按各组分应占的比例进行混合,在加热条件下,搅拌至均一、清澈的液体即可。第二种是真空蒸发法,第一步就将各组分溶于水,之后用蒸发器蒸发,反复进行称重、干燥,直至恒重,这可以通过将药品放在硅胶干燥器中实现。本实验选用第一种方法制备低共熔溶剂。
低共熔溶剂一般可以用下面的公式来表示出来
![]()
式中,Cat+是阳离子;X通常是卤化物阴离子,复杂的阴离子由X-和布朗斯特酸或路易斯酸组成;z指一定数量的与阴离子相互作用的Y粒子。
DES的分类基本取决于络合剂的使用,DES一般由MCl x和季盐组成。具体分类见表17-1。
表17-1 低共熔溶剂分类表(https://www.daowen.com)
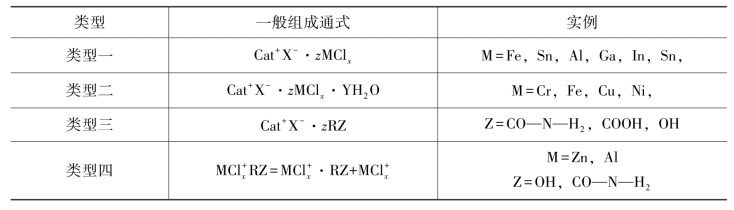
类型一的配位剂是一类金属盐,被广泛研究的是氯铝酸盐/咪唑盐的混合物,咪唑盐可以与各种金属卤化物形成各种常见的离子液体。在类型一中选择非水合金属卤化物组成低共熔溶剂的选择范围十分有限,但是类型二的配位剂可以选择水合金属盐,利用水合金属卤化物和氯化胆碱组成低共熔溶剂。第三类低共熔溶剂由氯化胆碱和氢键供体构成,并且它可以溶解很多金属物质,是目前研究中比较关注的一类低共熔溶剂。无机阳离子具有高的电荷密度,不能构成低共熔溶剂,然而最近的研究发现金属卤化物与尿素混合可以形成熔点低于150℃的低共熔溶剂。这种混合类型的低共熔溶剂被称为类型四。
胆碱类低共熔溶剂是用一定化学计量比的胆碱盐与配位剂组成的低共熔混合物,是一种新型的类离子液体,胆碱类中典型的一种是氯化胆碱/尿素低共熔溶剂。由于氯化胆碱是一种水溶性维生素,在动物生长发育过程中具有举足轻重的地位,可以调控动物脂肪沉积,进入动物体内,也可以通过氧化、磷酸化等途径代谢出去。因而氯化胆碱又称为“增蛋素”,可以把它加入禽畜饲料,可以使禽畜多产蛋、产仔以及增重。而尿素是几乎所有哺乳动物和某些鱼类体内蛋白质代谢分解的主要的含氮最终产物。尿素由肝脏产生后溶入血液,由肾脏排出。故两者混合产生的低共熔溶剂也是无毒、生物可降解的环境友好型的材料。同时,它又是一种良好的溶剂,可溶解多种金属矿物、金属盐及金属氧化物。
低共熔溶剂的凝固点比较低,低于组成它的物质,一般为-70~160℃,很多人对凝固点降低这一现象进行了解释,其中Abbott等(2003)认为这是胆碱盐与氢键供体在两个物质混合时,它们的晶格能的改变引起的。也有研究者认为这与氢键供体和低共熔溶剂中的阴离子结合方式有关。其中,氢键具有很重要的作用,氢键越强,其造成的电子离域越大,凝固点越低。如F-、[BF4]-、[NO3]-与尿素形成的低共熔溶剂的凝固点分别为1℃、67℃、12℃。这表明氢键的强弱可以影响低共熔溶剂的凝固点。氢键供体与氢键受体在不同的混合比例下,凝固点也是不同的。如氯化胆碱与苯乙酸,尿素,ZnCl2,CrCl3·6H2O以1∶2摩尔比相互混合时的熔点最低,如图17-1所示。
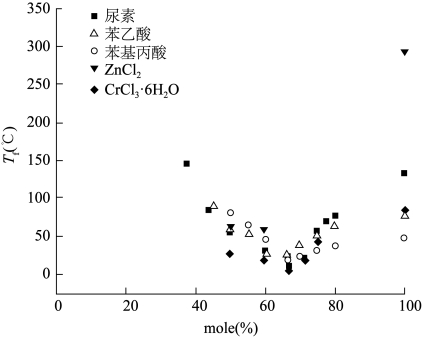
图17-1 氯化胆碱与其他物质在不同摩尔比下的凝固点
低共熔溶剂的电导率一般为0.1~12 mS/cm。电导率与很多因素相关,它与混合物组分的摩尔比相关;此外,它还与温度等环境因素有关。温度越高,它的电导率越高。低共熔溶剂的导电性还与其组分有关,加入不同的物质,导电性不同。电导率与黏度有关,并且具有负相关的关系,黏度越高,则其电导率越低;反之,黏度越低,则其电导率越高。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






