当各种燃料在自然条件下(温度很低时),尽管和氧接触,但只能缓慢氧化而不能着火燃烧。但是将温度提高到一定值后,燃料和氧的反应就会自动加速到相当大的程度,而产生着火和燃烧。由缓慢氧化状态转变到高速燃烧状态的瞬间过程称为着火,转变的瞬间温度称为着火温度。
煤粉与空气组成的可燃混合物的着火、熄火以及燃烧过程是否稳定地进行,都与燃烧过程的热力条件有关。因为在燃烧过程中,必然同时存在放热和吸热两个过程,这两个相互矛盾过程的发展,对燃烧过程可能是有利的,也可能是不利的,它会使燃烧过程发生(着火)或者停止(熄火)。
下面以煤粉空气混合物在燃烧室内的燃烧情况,来说明这个问题。
燃烧室内煤粉空气混合物燃烧时的放热量Q1为
在燃烧过程中向周围介质的散热量为
式中 CO2——煤粉空气混合物中煤粉反应表面的氧浓度;
n——燃烧反应式中氧的反应方次(反应系数);
V——煤粉空气混合物容积;
Qr——燃烧反应热;
T——反应系统温度;
α——混合物向燃烧室壁面的综合放热系数,它等于对流放热系数和辐射放热系数之和;(https://www.daowen.com)
S——燃烧室壁面面积;
Tb——燃烧室壁面温度。
根据式(5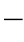 27)、式(5
27)、式(5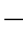 28)可画出放热量Q1和散热量Q2随温度的变化曲线,如图5
28)可画出放热量Q1和散热量Q2随温度的变化曲线,如图5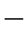 8所示,放热曲线是一条指数曲线,散热曲线则接近于直线。
8所示,放热曲线是一条指数曲线,散热曲线则接近于直线。
图5 8 放热和散热曲线
8 放热和散热曲线
当燃烧时壁面温度Tb1(即煤粉气流的初始温度)很低时,此时散热曲线为Q2′,它与放热曲线Q1相交于点1。由图可知,在点1以前的反应初始阶段,由于放热大于散热,反应系统开始升温,到达点l达到放热、散热的平衡。而点1是一个稳定的平衡点,亦即反应系统的温度稍微变化(升高或降低),它始终会回复到点1稳定下来。但点l处的温度很低,煤粉处于缓慢氧化状态,这时煤粉只会缓慢氧化而不会着火。
如果将煤粉气流的初始温度(即燃烧室壁面温度)提高到Tb2,此时相应的散热曲线为Q2″。由图可知,在反应初期,由于放热大于散热,反应系统温度逐渐增加,至点2达到平衡。但点2是一个不稳定的平衡点,因为只要稍稍地增加系统的温度,放热量Q1就大于散热量Q2,即反应温度不断升高,一直到点3才会稳定下来。点3是一个高温的稳定平衡点,因此只要保证煤粉和空气的不断供应,反应将自动加速而转变为高速燃烧状态,点2对应的温度即为着火温度Tzh。
对于处在高温燃烧状态下的反应系统,如果散热加大了,反映系统的温度便随之下降,散热曲线变为Q2‴,它与放热曲线Q1相交于点4。由于点4前后都是散热大于放热,所以反应系统状态很快便从点3变为点4,点4是一个不稳定的平衡点。只要反应系统温度稍微降低,便会由于散热大于放热,而使反应系统温度自动急剧下降,一直到点5的地方才稳定下来。但点5处的温度已很低,此处煤粉只能产生缓慢的氧化,而不能着火和燃烧,从而使燃烧过程中止(熄火)。因此,只要到达了点4状态,燃烧过程即会自动中断,点4状态对应的温度即为熄火温度Txh。由图可知,熄火温度Txh是大于着火温度的。
由上述分析可知:散热曲线和放热曲线的切点2和4,分别对应于反应系统的着火温度和熄火温度。然而点2和点4的位置是随着反应系统的热力条件——散热和放热的变化而变化的。因此,着火温度和熄火温度也是随着热力条件的变化而变化的,并不是一个物理常数,只是一定条件下得出的相对特征值。
在相同的测试条件下,不同燃料的着火、熄火温度不同;而对同一种燃料而言,不同的测试条件也会得出不同的着火温度。对煤而言,反应能力愈强(Ddaf越高,焦炭活化能越小)的煤,其着火温度越低越容易着火,也越容易燃尽;反之,反应能力越低的煤,例如无烟煤,其着火温度越高,越难于着火和燃尽。
从上面的分析可知,要加快着火,可以从加强放热和减少散热两方面着手。在散热条件不变的情况下,可以增加可燃混合物的浓度和压力,增加可燃混合物的初温,使放热加强;在放热条件不变时,则可采用增加可燃混合物初温和减少气流速度、燃烧室保温等减少放热措施来实现。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







