燃烧速度的基本定义是单位时间和单位体积内烧掉的燃料量或消耗掉的氧量。燃烧是化学反应,可用化学反应速度来表示燃烧速度。如燃料燃烧的化学反应方程式为
式中 a、b——燃料A、氧化剂B的化学反应计量系数;
g、h——燃烧产物G、H的化学反应计量系数。
化学反应速度可以用某一反应物浓度减少的速度(反应物消耗的速度)表示,也可以用生成物浓度增加的速度表示,其常用的单位是mol/(m3·s)。按不同反应物或生成物计算在时间t的瞬时反应速度为
式中 CA、CB、CG、CH——反应物A、B和生成物G、H的浓度。
影响燃烧速度的几个主要因素。
1.反应物浓度的影响
化学反应是在一定条件下,不同反应物分子彼此碰撞而产生的,单位时间内碰撞次数越多,则化学反应速度越快。分子碰撞次数决定于单位容积中反应物的分子数,即物质浓度。化学反应速度与浓度的关系可以用质量作用定律来说明。
报据质量作用定律,对于均相反应,在一定温度下化学反应速度与参加化学反应的各反应物的浓度成正比,而各反应物浓度项的方次等于化学反应式中相应的反应系数。对式(5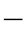 14)表示的化学反应,其反应速度可表示为
14)表示的化学反应,其反应速度可表示为
式中 kA、kB——反应物A、B的化学反应速度常数,与反应物浓度无关。
图5 3 燃烧速度与反应物相对浓度的关系
3 燃烧速度与反应物相对浓度的关系
质量作用定律说明,在一定温度下而反应容积不变时,增加反应物的浓度即增大反应物的分子数,分子间碰撞的机会增多,所以反应速度加快。当然,反应物浓度不是越高越好,反应物浓度过高,则氧相对不足,燃烧不充分。只有当燃料与氧达到化学当量比时,即反应物相对浓度等于0.5时,燃烧速度最快,如图5 3所示。
3所示。
2.温度的影响
温度对化学反应速度有很大的影响,可以用阿累尼乌斯定律表示:(https://www.daowen.com)
式中 k——反应速度常数;
k0——频率因子,常数,由试验确定;
E——活化能,反应物的反应特性常数;
T——反应温度;
R——通用气体常数。
式(5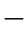 17)说明,当反应物浓度不变时,化学反应速度与温度成指数关系,随着温度升高,化学反应速度迅速加快。
17)说明,当反应物浓度不变时,化学反应速度与温度成指数关系,随着温度升高,化学反应速度迅速加快。
E是燃料的活化能,表征燃料的燃烧反应速度。化学反应是通过反应物分子间的碰撞而进行的,但并不是所有的碰撞都能引起化学反应,只有其中具有较高能量活化分子的碰撞才能发生化学反应。为使化学反应得以进行,具有平均能量的分子转变为活化分子所需的最低能量称为活化能,以E表示。能量达到或超过活化能E的分子成为活化分子。活化分子的碰撞才是发生化学反应的有效碰撞。当温度升高时,分子从外界吸收了能量,活化分子急剧增多,化学反应速度加快。
图5 4 活化能
4 活化能
在一定温度下,活化能越大,活化分子数越少,则化学速度越慢;反之,若活化能越小,化学反应速度就越快。在相同条件下,不同燃料的焦炭的燃烧反应,其活化能是不同的,高挥发分煤的活化能较小,低挥发分煤的活化能较大。
由图5 4可知,要是反应物A反应生成燃烧产物G,必须先吸收能量E1,达到活化状态,然后进行燃烧反应,变成产物G,同时放出热量E2。扣除吸收的热量E1,Q为燃烧反应的净放热量,也就是燃料的发热量。
4可知,要是反应物A反应生成燃烧产物G,必须先吸收能量E1,达到活化状态,然后进行燃烧反应,变成产物G,同时放出热量E2。扣除吸收的热量E1,Q为燃烧反应的净放热量,也就是燃料的发热量。
实际的炉内燃烧过程,反应物的浓度、炉膛压力可认为基本不变,因此化学反应速度主要与温度有关。温度升高时,活化分子数目急剧增多,反应速度也随之加快。而且活化能数值越大,温度对反应速度的影响就越显著。实际运行中,提高炉膛温度是加速燃烧反应,缩短燃烧时间的重要方法。
3.压力的影响
气态物质参加的反应,在反应容积不变的情况下,反应系统压力的增高,就意味着反应物浓度增加了,从而使反应速度加快。燃烧速度正比于压力的n次方,即压力的方次为反应级数。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




