掺杂的LaCrO3在高氧气分压下生成Cr4+,在还原气氛中生成氧空位。连接体的重要功能为没有电化学氧气渗漏下导电,因而应该阐明与Ce3+/Ce4+转变有关的缺陷化学和氧空位的生成。几个作者已经讨论了掺杂的LaCrO3的缺陷化学:Weber等人和Mizusaki等人讨论了Sr掺杂的LaCrO3[21,23],Yasuda等人和Onuma等人讨论了Ca掺杂的LaCrO3[22,24],Oishi等人讨论了LaCr(M)O3[25]。利用Kröger-Vink符号,氧空位生成的反应可以表示如下:
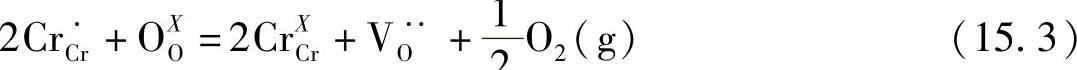
上述反应的平衡常数可以写作
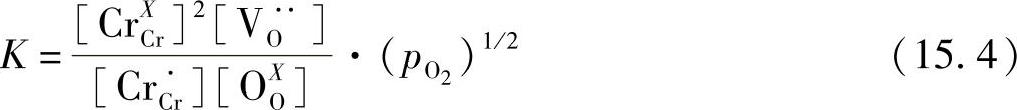
电荷中性条件可以表示如下:

利用La1-xMxCrO3-d的化学式,假设如下等式:
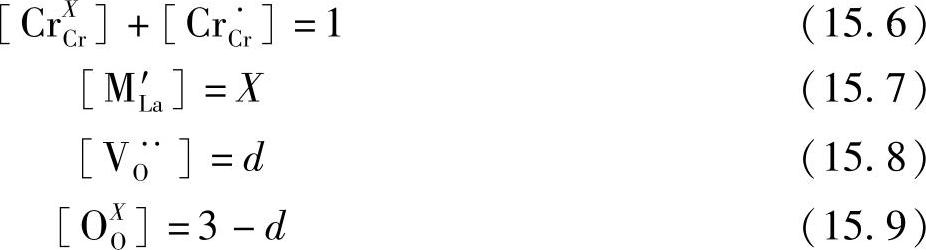
反应的平衡常数采用式(15.6)~式(15.9)表示:
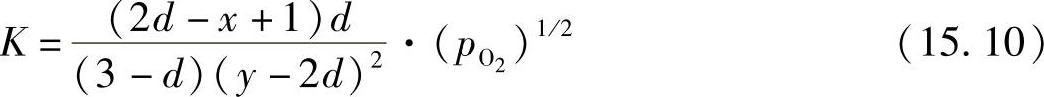
通过拟合测试数据可以得到K值,La0.7Ca0.35CrO3-δ最好的拟合K值为9×108atm0.5。图15.4显示了测试的氧的数目对氧气分压的曲线,氧的数目随着氧气分压的减小从3开始降低,因此LaCrO3晶格上形成了氧空位,是氧离子的扩散途径。由于连接体材料被置于大的氧电位梯度上,氧气能借助氧空位(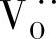 )通过LaCrO3基材料渗透[26-30],当氧离子从高氧气分压向低氧气分压迁移时,电子向相反方向移动。根据常规,当氧离子从左侧(高氧气分压)向右侧(低氧气分压)移动时,氧渗电流密度为负,如图15.5所示,可根据下式计算氧离子的渗电流密度:
)通过LaCrO3基材料渗透[26-30],当氧离子从高氧气分压向低氧气分压迁移时,电子向相反方向移动。根据常规,当氧离子从左侧(高氧气分压)向右侧(低氧气分压)移动时,氧渗电流密度为负,如图15.5所示,可根据下式计算氧离子的渗电流密度:
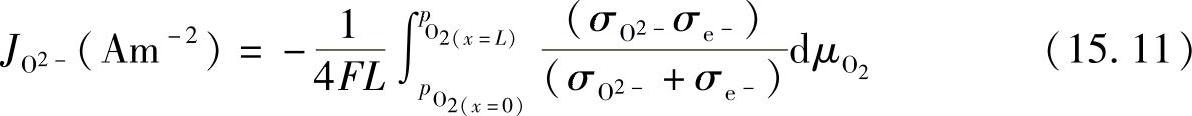
式中 F——法拉第常数;
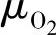 ——氧气的化学电位;
——氧气的化学电位;
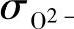 ——氧离子电导率;
——氧离子电导率;
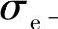 ——电子的电导率;
——电子的电导率;
L——LaCrO3厚度。
如果电子电导率足够高,上述公式可以被简化如下:(https://www.daowen.com)
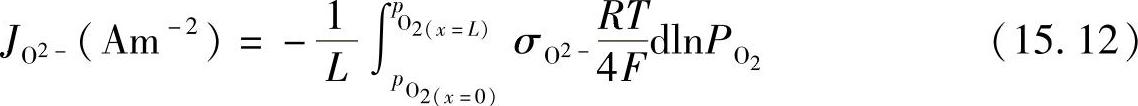
式中 R——气体常数;
T——温度。
上述式子显示了氧离子的渗电流密度可根据通过致密的LaCrO3的氧离子的电导率进行计算。为了计算氧离子的电导率,可采用如下式子:
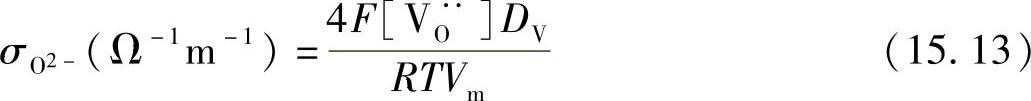
式中 R——摩尔气体常数(单位为Jmol-1K-1);
T——温度(单位为K);
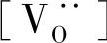 ——氧空位摩尔分数;
——氧空位摩尔分数;
DV——氧空位扩散系数(单位为m2s-1);
Vm——LaCrO3的摩尔体积。
空穴浓度由实验和计算的氧气非计量数据确定,对LaCrO3基氧化物中氧气化学电位的分布以及氧气的电化学渗漏进行了精确的分析。计算的氧离子渗电流密度(J(O2-)/mA cm-2)如图15.6所示,在900℃(1173K)时,渗电流密度在任何被测的总电流密度中(就La0.7Ca0.3CrO3-δ而言)低于80mA/cm2,但是在大于950℃(1223K)的高温下,渗电流密度高于100mA/cm2,在总电流密度的10%以上[28,29],与超过电流密度相比这个值显然是大的。采用电子阻断电化学法和氧同位素交换(16O/18O交换)法实验确定了氧通过LaCrO3基氧化物陶瓷的渗透[30,31],测得的氧渗电流密度在1273K温度、10-13Pa(约10-18atm)下约为3~10mA/cm2(假设厚度为3mm),测得的电流密度与计算值相比相当小,归因于LaCrO3的表面氧的反应。氧渗透需要氧分子到氧离子(O2-)的离子化过程,低的表面反应能降低通过LaCrO3的渗流,甚而降低渗电流密度。通过氧同位素交换法确定了La0.7Ca0.3CrO3中氧空位扩散系数[氧空位扩散系数(DV)在1273K时约为10-5cm2s-1][31],不同Ca浓度的DV值几乎在相同的数量级(10-5cm2s-1)上,DV的活化能约为77~142kJ/mol[28]。
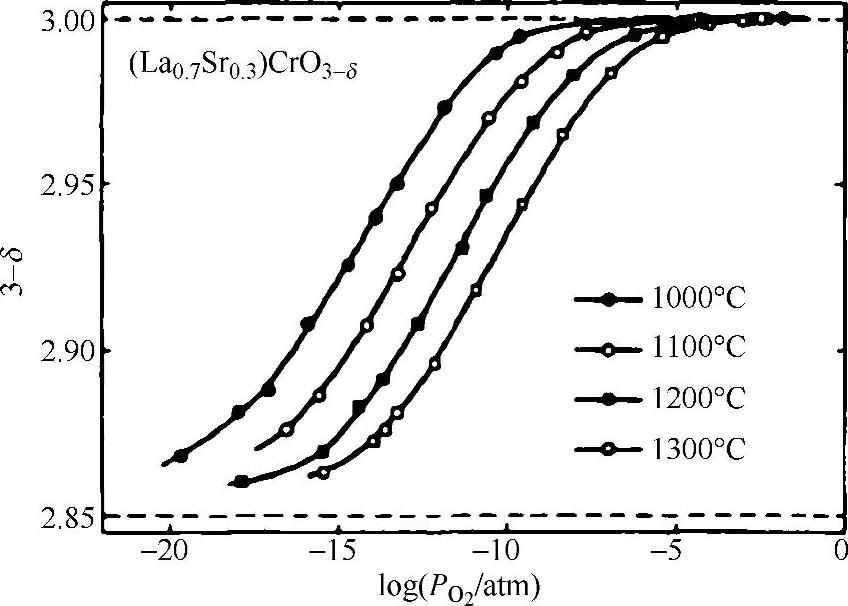
图15.4 1273~1573K时测定的La0.7Ca0.3CrO3-δ的氧数目对氧分压(经Elsevier科学出版社允许重印[23])
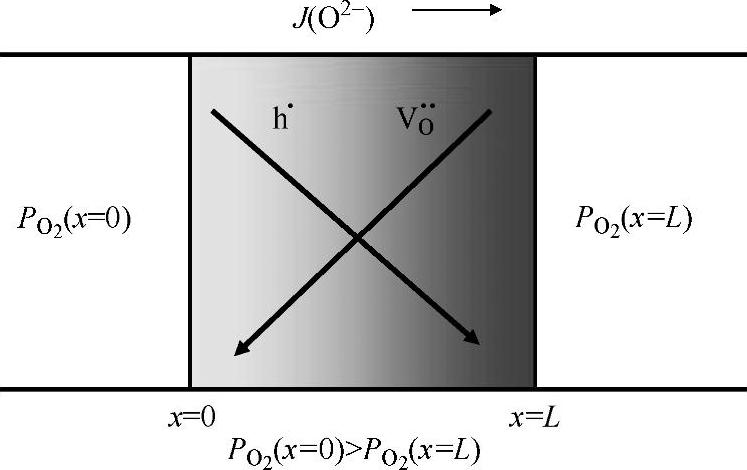
图15.5 氧通过LaCrO3连接体渗透的示意图
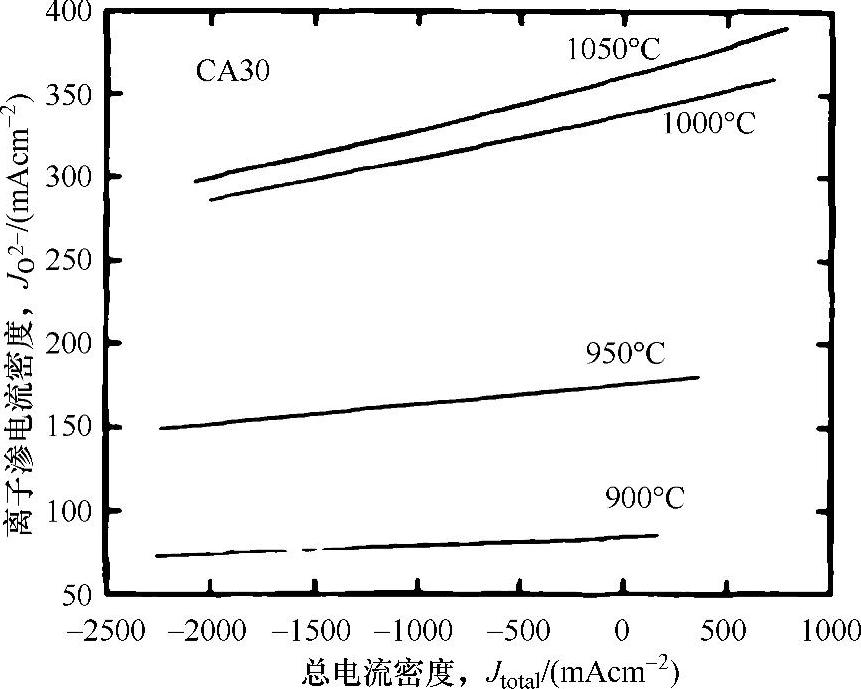
图15.6 通过LaCrO3连接体的氧渗电流密度[在氧电位梯度下La0.7Ca0.3CrO3中离子渗电流密度和总电流密度间的关系,假设LaCrO3板的厚度为3mm(经电化学学会允许重印[28])]
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








