由于碱土金属具有强碱性,质子导体与CO2反应[5,8-10],钙钛矿型氧化物将发生碳化反应:
ABO3+CO2=ACO3+BO2 (12.5)
式中 A——Ba或Sr;
B——Ce或Zr。
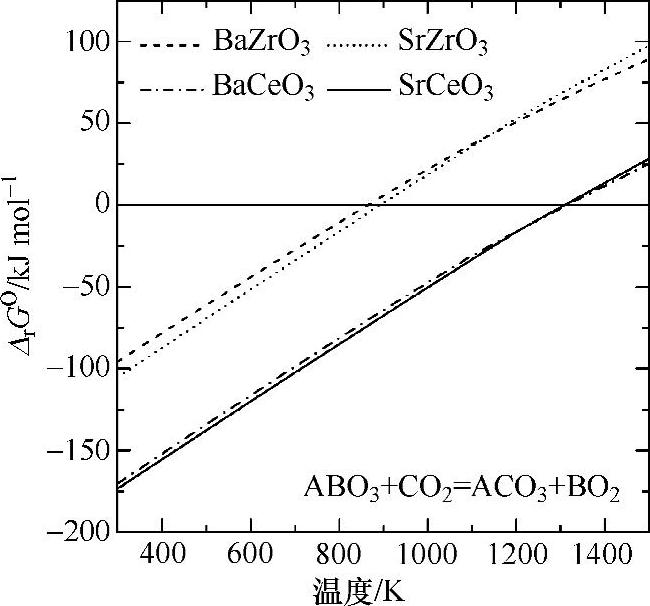
如图12.4所示,该反应与1barCO2发生在临界温度以下(对铈酸盐约为1300K,对锆酸盐约为850~900K)[19,20]。因此,如果烃类与铈酸钡基电解质用于燃料电池,电池应在高于临界温度的温度下运行以避免与CO2反应遭到损坏。一些研究表明,铈酸盐锆酸盐固溶体在CO2中是稳定的[21-23]。图12.5显示了与二氧化碳处理前后SrCe0.95Yb0.05O3-α、SrZr0.9Y0.1O3-α和BaCe0.6Zr0.3Nd0.1O3-α的X射线衍射(XRD)谱图。烧结的钙钛矿在100%CO2和H2-CO-CO2混合气中暴露在800℃下3h。SrCe0.95Yb0.05O3-α暴露于CO2和H2-CO-CO2混合气中生成了CeO2和SrCO3,如图12.5a所示。很明显电解质与CO2反应生成SrCO3和CeO2,如式(12.6)所示。
 (https://www.daowen.com)
(https://www.daowen.com)
图12.4 由热力学数据计算的铈酸碱土和锆酸碱土的碳化反应的标准吉布斯函数变对温度作图[20][标准压力,p°=1×105Pa(经施普林格科学和商业媒体出版社允许重印[24])]
SrCeO3+CO2→SrCO3+CeO2 (12.6)
碳化反应的发生与图12.4显示的热力学数据一致。CO2处理前后SrZr0.9Y0.1 O3-α的XRD谱图如图12.5b所示,强度轴扩大到能反映出微小成分。两种气氛处理后XRD谱图完全没有变化。图12.5c中BaCe0.6Zr0.3Nd0.1O3-α暴露于CO2后XRD图谱显示几乎没有变化。当细微观察XRD图谱时,在CO2或H2-CO-CO2混合气处理后观察到33°和47°处的弱反射峰可能来自CeO2,怀疑是钙钛矿结构的分解[见式(12.6)],另一种可能是钡在试样表面的蒸发导致CeO2-ZrO2莹石的形成,应检查固溶体的长期稳定性。
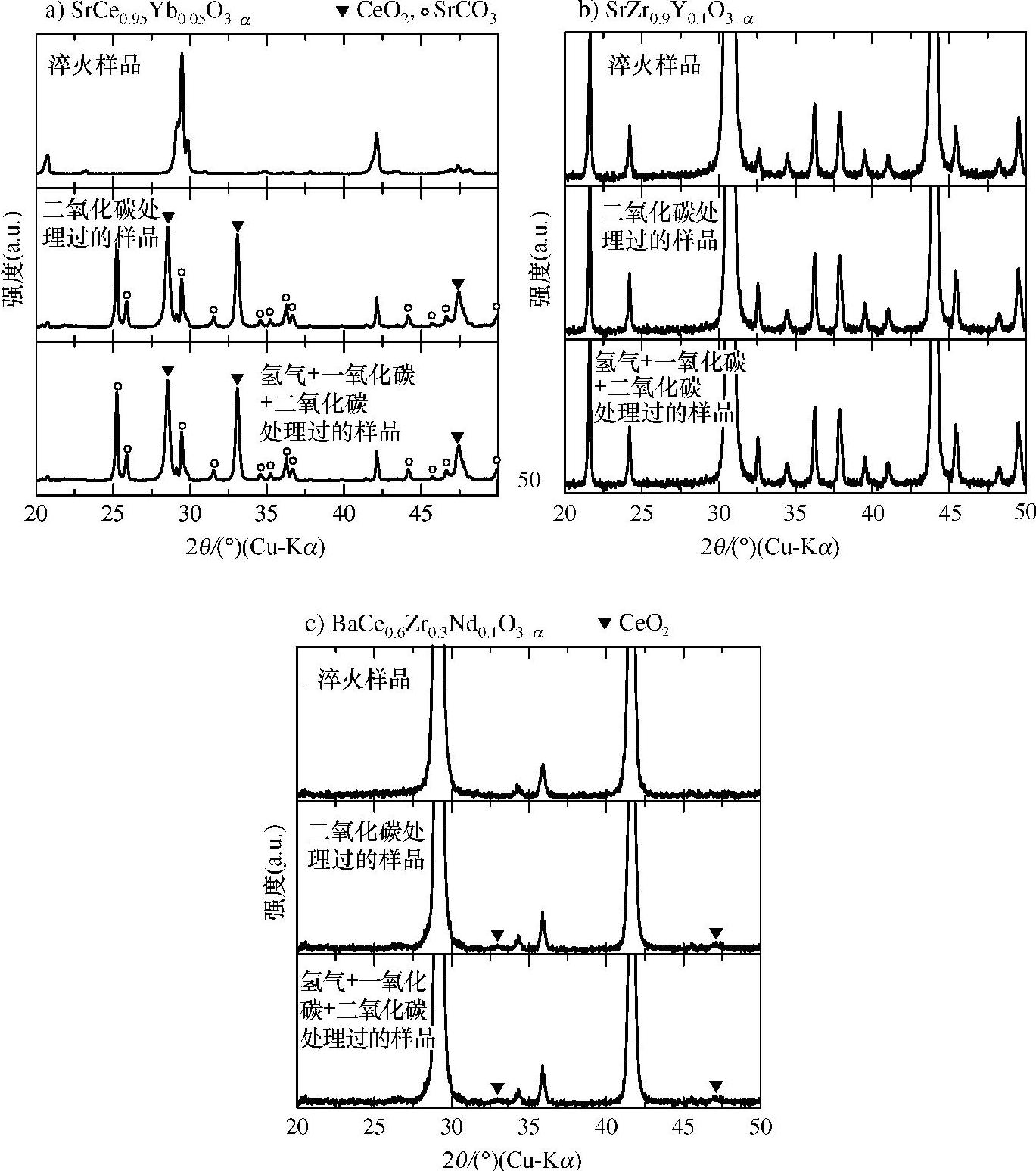
图12.5 800℃下在CO2和H2-CO-CO2混合气中处理3h制备的SrCe0.95Yb0.05O3-α(图12.5a)、SrZr0.9Y0.1O3-α(图12.5b)和BaCe0.6Zr0.3Nd0.1O3-α(图12.5c)的XRD谱图[24][混合气包括摩尔比为21的H2和CO,与20%的CO2混合。CO2和 CO-CO2混合气用
CO-CO2混合气用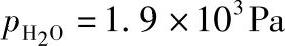 (17.0℃下饱和)的水蒸气润湿,电解质暴露在含CO2的气氛中3h,适度淬火到室温(从800℃到200℃约10min),通过XRD测定电解质表面的晶相变化(经施普林格科学和商业媒体出版社许可重印[24])]
(17.0℃下饱和)的水蒸气润湿,电解质暴露在含CO2的气氛中3h,适度淬火到室温(从800℃到200℃约10min),通过XRD测定电解质表面的晶相变化(经施普林格科学和商业媒体出版社许可重印[24])]
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






