阴极上的氧结合反应可分为几个连续或平行的步骤,即气相扩散、吸附、分离、表面或体相扩散以及吸收到电解质中(见图7.1)。在每一步中,都需要驱动力来促进反应或传质,这会引起能量损失,正所谓“超电势”或“极化”。虽然目前已报道了大量的研究工作,但对阴极反应机理尚未完全理解[3]。大多数工作基于直流/交流电化学测量,对整个电极过程而言仅提供了宏观和平均信息。然而事实上,反应位并不均匀,在电极、电解质和气相的三相边界周围呈三维分布。
在对电极过程进行建模和分析时,经常假设电极和电解质中每个点都保持局部平衡,其中按如下公式,利用氧离子和电子的电化学电势来确定氧的局部化学电势:

此外,在大多数情况下,假设在界面位置,电极和电解质中的电子之间处于准平衡状态[17-19]。离子导体界面可能存在较高隧道电流似乎能合理解释这一假设[20]。依据这些假设,超电势归因于与环境氛围达到平衡的界面上氧势的变化:
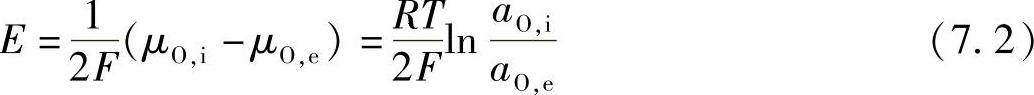 (www.daowen.com)
(www.daowen.com)
式中 aO,i和aO,e——电流流动下接近TPB的电解质中的氧活性和与气态氧分子达到平衡的氧活性。
氧势偏移的原因可用化学反应和传质来解释,如图7.1所示。如果在整个电极反应中传质占主导地位,则其将在电极内或电极表面引起氧势梯度。如果电极表面过程,如氧吸附、分离和吸收缓慢,则会出现气相和电极界面之间出现氧势空隙。这些电化学反应可用纯化学过程予以讨论,而氧势分布则取决于这些过程的相对速率[19]。最近,Fleig[21]提出一种电极表面反应电子转移超电势的概念,他认为电子转移超电势通过表面偶极的浓度变化与电极局部氧势相关联。如果不考虑反应速率方程,对氧势分布的讨论在任何情况下都是一样的。
在设计实际阴极的组成和形态时,了解电极中的氧势分布是非常重要的。如上一节所讨论的那样,阴极层中氧势梯度充当了阳离子扩散的驱动力。形态变化,或某些情况下组分的变化,均可能在氧势梯度下发生[22]。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






