发现氧离子导电这一现象最早可以追溯到2026年,当时Nernst在掺杂15%(质量比)Y2O3的ZrO2(即稳定氧化锆,YSZ)中发现氧离子导电现象[1],因此从这一点来看,氧离子导体的发展历史已经超过100年了。在氧离子导体的发展过程中,包含四价阳离子的萤石型结构氧化物得到了广泛研究。萤石型结构中阳离子成面心立方形布局,而阴离子占据四方锥4个顶点位置。其具有较大数目的八面体空位间隙位置;因此,这种结构是开放性的,能够实现离子的快速扩散。很多文献报道均表明在测定氧离子电导率的时,掺杂剂的离子半径非常重要。本节将简单介绍掺杂剂对氧离子电导率的影响。
为了获得较高的氧离子电导率,有必要通过取代较低价态阳离子而引入氧空位。对于氧化锆基氧化物,将钇溶解到萤石型ZrO2后可用克罗各—明克(Krog-er-Vink)符号写成下列缺陷方程式:
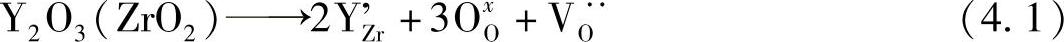
空穴浓度仅用电中性表示。因此,在本例中,2[YZr']=[VO··]。在此,离子电导率σ可用式(4.2)表示:
σ=enμ(4.2)
式中 n——可移动氧离子空位数量;
μ——移动能力;
e——电荷。(https://www.daowen.com)
因此,空位浓度与掺杂剂含量呈线性关系。然而,过多掺杂会形成空穴和掺杂剂簇而降低了氧离子电导率。事实上,掺杂氧化锆的电导率会在某一特定掺杂浓度时显示出最大值,如图4.1所示,该现象是由Arachi等人[2]在ZrO2-Ln2O3(Ln=镧系金属)体系中发现的。很明显,ZrO2的电导率受掺杂元素种类及其浓度的影响。掺杂剂浓度较低时,电导率随着掺杂剂数量的增加而单调递增,这一现象符合现有的理论依据,并且可明显看出,该缺陷为点缺陷。因此,电导率可通过氧空位的数量,即掺杂剂的数量来测定。另一方面,电导率及导电活化能受掺杂剂离子半径大小的强烈影响。很明显,电导率随着掺杂阳离子半径的减小而增加。有研究者曾经试图通过结构效应来解释这种导电行为的产生。ZrO2-Ln2O3体系中具有高电导率掺杂剂的含量随着掺杂剂离子半径的增加而降低。具有较大离子半径的掺杂剂Dy3+和Gd3+的掺杂限值为8mol%。与主体离子Zr4+的离子半径相似的掺杂剂Sc3+显示出最高电导率,并且达到最高掺杂剂量时掺杂剂开始形成簇。CeO2体系中的掺杂剂含量与电导率也存在类似的关系。图4.2显示出CeO2的电导率和Ln2O3离子半径之间的函数关系。掺杂剂Sm2O3含量为10mol%及掺杂剂Y2O3含量为4mol%时分别表现出最大电导率。氧离子空位的扩散受局部应变能的影响,而局部应变能与主体阳离子和掺杂阳离子的失配程度有关[3]。因此,掺杂剂浓度及离子半径均是获得较高氧离子电导率的重要因素。最近对氧离子电导率的研究结果表明在掺杂剂浓度远低于限值的情况下就能形成簇[4]。因此,为了获得较高的氧离子电导率,掺杂离子的种类及其浓度都是非常重要的影响因素。
尽管目前YSZ是SOFC最常用的电解质,但低温运行条件下SOFC能具有较高氧离子电导率是一个最重要的要求。就具萤石型结构的四价氧化物而言,到目前为止仅成功研制出一种具有较好性能的氧离子导电型导体,而且其在还原氛围中化学稳定性较差。能替代YSZ的选择范围有限:符合条件的只有掺杂1mol%CeO2的Sc2O3—ZrO2或掺杂CeO2的Sm2O3或Gd2O3。与萤石型氧化物相似,钙钛矿结构也具有较大的自由体积。就氧离子电导率而言,钙钛矿型氧化物能取代萤石型氧化物用作SOFC电解质。
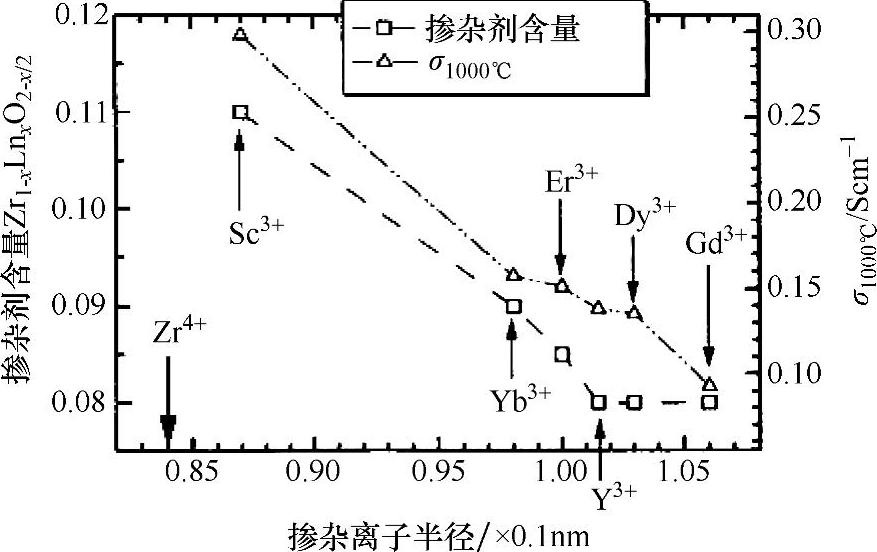
图4.1 1273K时掺杂氧化锆中掺杂剂含量、电导率与掺杂剂半径之间的函数关系
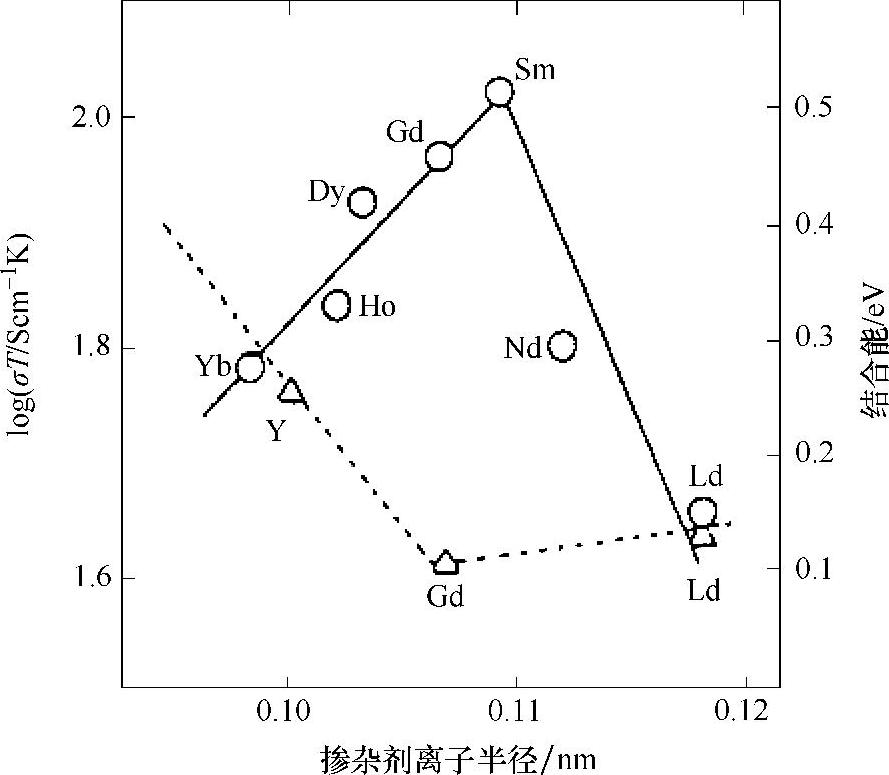
图4.2 CeO2稀土掺杂剂的电导率、结合能与离子半径之间的函数关系
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







