当钙钛矿型氧化物ABO3中的部分阳离子A或B被其他低价阳离子取代后,有时在晶体中会产生数量相对较多的氧离子空位以维持晶体的电中性。此时,这类氧化物的化学组成可表示为A1-xMxBO3-α或AB1-xMxO3-α,其中α是单位分子式内氧空位的平均数。在此晶体中,如果氧离子从其本位跃迁至临近空位所需的能量不高,那么在较高的温度下有望具有较好的氧离子导电性。与稳定氧化锆类似,在此情况下,氧离子可在氧离子空穴的协助下迁移出晶格。
有些方法可验证氧化物中的氧离子导电。其中最为方便的方法就是检测氧浓度差电池的放电性能。如果导电性源于样品中的氧离子,那么以该氧化物样品为固体电解质的氧浓度差电池将释放一定数量的稳定电流。因此,如果电池[1]所示的氧浓度差电池具备稳定的电动势并释放一定数量的稳定电流,那么该氧化物就具备氧离子导电性。
追溯历史,钙钛矿型氧化物的氧离子导电性最初由Stephenson和Flanagan[4]提出(如3.2节所述)。他们当时试图利用更新的氧浓度差电池(见参考文献[3])构造燃料电池。在该实验中,PZT被用作电解质,而氢气和氧气分别充入电解质的两侧。他们观察到在325℃的温度下其终端电压为0.81V,而在700℃下的终端电压为0.41V。输出电流预计为几个mA/cm2。作者当时写到:“这些结果表明,至少有一部分导电性是由于氧离子迁移所造成的”。这一研究首次通过实验证实了钙钛矿型氧化物的氧离子导电,并且是首次使用钙钛矿型氧化物作为固体电解质进行的SOFC实验。尽管,他们当时的意图并非想去开发燃料电池及其固体电解质。
van Gool首先提出开发具有钙钛矿结构的良离子导体的研究,并因其首次提出建造单室SOFC而闻名。1965年,他就单室燃料电池发表了一篇题为“Thep-ossible use of surface migration in fuel cells and heterogeneous catalysis(燃料电池和多相催化中使用表面迁移的可能性)”的论文[11]。在该论文中,他提到了可考虑使用氧缺位钙钛矿型氧化物作为燃料电池电解质的氧化物离子导体。然而,他同时认为钙钛矿结构似乎对此不利,因为ABO3中A和O会导致晶体结构的致密堆积,从而使得其中的离子迁移变得非常困难。
针对钙钛矿型化合物进行高效离子导电的研究开始于20世纪60年代后期,当时的研究目标是为燃料电池和传感器寻找性能优异的电解质。研究者通过萤石型氧化物类氧离子导电而推算出一定浓度的氧空位有助于使其具备较好的氧离子导电性。目前,该作者及其合作者注意到了基于LaAlO3的固体溶液,其中包含了尺寸较大的La3+及尺寸较小的Al3+。在这种氧化物中,Ca2+部分取代了La3+,因此形成了氧离子空位以保证晶体电中性[12],即可将其表示为La1-xCaxAlO3-α。对以La1-xCaxAlO3-α(x=0.1、0.2和0.3)陶瓷为固体电解质的氧浓度差电池和燃料电池的行为进行研究后,他们确认在空气氛围的高温下,该物质的导电性部分来自氧离子,另一部分来自电子(因产生电子空穴所致),而在燃料电池氛围下,导电性主要源于氧化物离子[13]。CaTiO3可接受铝而形成固体溶液CaTi1-xAlxO3-α(x≤0.5),其中会产生近似化学计量比数量的氧空位[14]。实验结果表明,这种固体溶液展现出与La1-xCaxAlO3[15]相似的传导行为,且其阳离子传导性高于后者。这些研究成果于1967年和1979年[2]在日本的相关期刊上发表,1971年,这些研究成果被重新整理,并用英文发表[16]。Steele等人还报道了CaTiO3其陶瓷的氧离子传导性[17]。
CaTiO3是一种典型的2∶4型钙钛矿,其中包含尺寸较大的Ca2+以及较小的Ti4+,而前面提及的LaAlO3是典型的3∶3型钙钛矿,其中包含较大的La3+以及较小的Al3+。Ishihara率先发现性能优异的氧离子导体[18]也是基于3∶3型的钙钛矿LaGaO3,该成果于1994年报道,详细信息将在第4章中介绍。
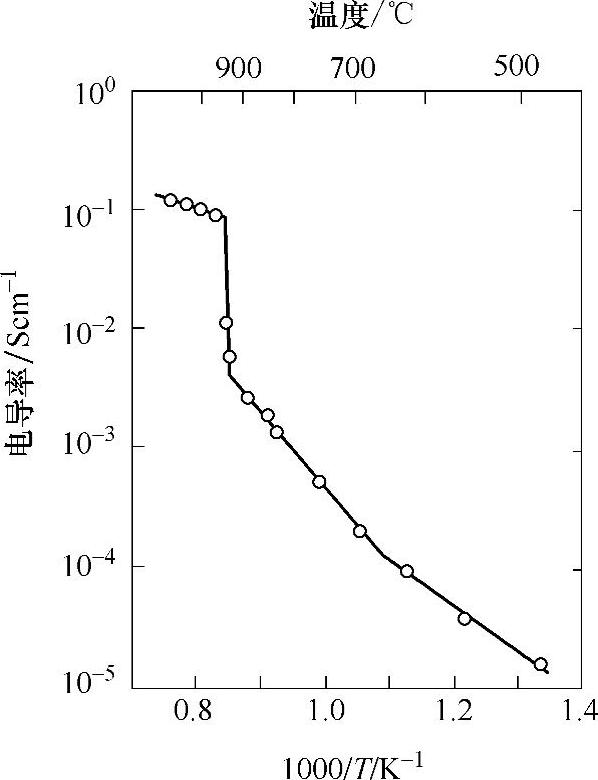
如前所述,具钙钛矿结构的氧离子导体属于单钙钛矿,可表示为ABO3。除此之外,还有其他不同类型的钙钛矿型氧化物,有一些显示出了氧离子导电性。其中一种是钙铁铝石Ba2In2O5,亦可写作BaInO2.5,可以看作每单位分子式中出现了0.5个氧空位,因此还可表示为BaInO2.5□0.5,其中□代表氧空位。温度低于930℃时,氧空位的排列是有序的[19]。Goodenough等人发现温度高于930℃时,钙铁铝石的氧化物离子导电性增大了不止一个数量级,如图3.3所示[20]。温度高于930℃时,氧离子空位呈现无序状态,并且在无序空位的协助下,氧离子移动变得更为自由。
 (www.daowen.com)
(www.daowen.com)
图3.3 Ba2In2O5的电导率与温度的函数关系[20]
钙钛矿型氧化物离子导体的一个突出特点是在高温的氧化氛围中(比如空气氛围)经常伴随p型电子导电。如3.2节所述,电子导电的贡献率取决于氧分压及温度。图3.4示出了800℃时CaTiO3-和SrTiO3-基固体溶液的导电性[16]。在氧分压高的区域出现了p型电子导电,而在氧分压低的区域(即还原氛围)出现了n型电子导电。实际上,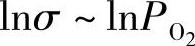 曲线的形状如图3.1所示。氧化氛围下[甚至p(O2)=1atm[3]],在稳定氧化锆及掺杂氧化铈等萤石类氧化物离子导体中很少能观察到p型电子导电;而在高温氧化氛围下,很多钙钛矿型氧化物离子导体变成混合型导体(O2-和h+)。在气相反应中,由于氧缺陷的出现而导致空穴导电:
曲线的形状如图3.1所示。氧化氛围下[甚至p(O2)=1atm[3]],在稳定氧化锆及掺杂氧化铈等萤石类氧化物离子导体中很少能观察到p型电子导电;而在高温氧化氛围下,很多钙钛矿型氧化物离子导体变成混合型导体(O2-和h+)。在气相反应中,由于氧缺陷的出现而导致空穴导电:

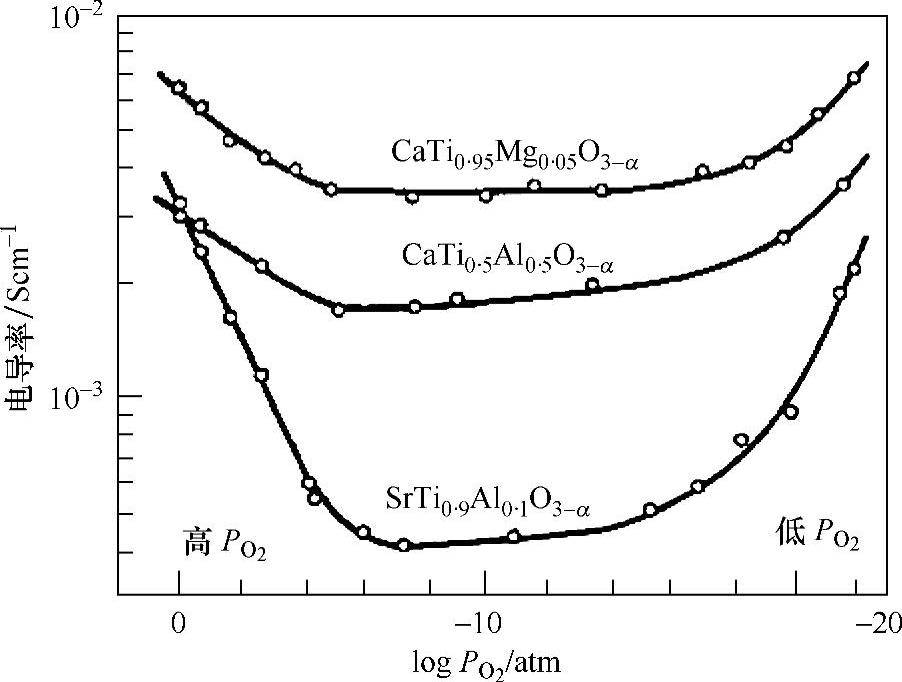
图3.4 800℃下CaTiO3—SrTiO3基固体溶液电导率与氧分压间的关系[16]
在很多钙钛矿型氧化物离子导体中,平衡常数K1很大,所以在相对较弱的氧化氛围(比如空气)中也会出现空穴导电,而对萤石型氧化物(比如稳定氧化锆),平衡常数K1相对较小,以至于在高温空气氛围中会出现p型电子导电。
有一些B位存在过渡金属的钙钛矿型氧化物于高温下呈现出了混合导电性能。掺杂钴酸镧就是一个非常典型的例子,其中氧离子及空穴充当载流子。尽管离子导电性已经很高(比如,几百摄氏度下,电导率﹥10-1S cm-1),但是其电子电导率比氧离子电导率高出几个数量级。这类混合导体是SOFC电解质及陶瓷膜反应器的备选材料,详细信息见第7章和第8章。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






