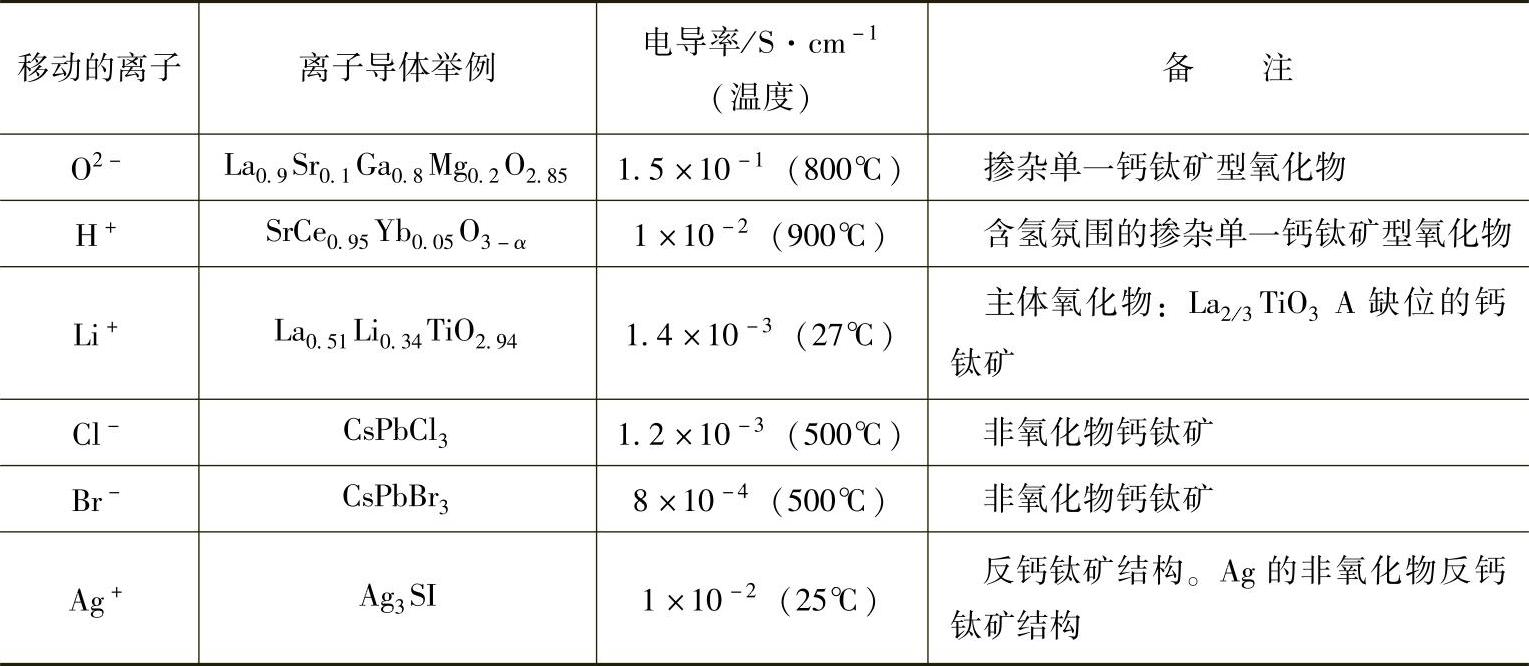
有助于提高钙钛矿型化合物导电性的离子种类有限,表3.1列出了一些典型的化合物及其导电性与特性。移动性离子(氢除外)是这类化合物的主体成分,而质子是特殊的,因为在环境大气压和较高的温度下它们容易与水蒸气或氢气结合在一起。在这些化合物中,氧化物离子导体广为人知,并且各种钙钛矿及其相关氧化物的离子导电性也得到广泛研究。
表3.1 钙钛矿型化合物中离子导电实例
可用不同的方式证实电子导电性氧化物中的离子传导性,最为简便的方法之一是测定电化学氧浓度差电池的电动势(emf):
Pt,O2(PO2(1))/氧化物样品/O2(PO2(2)),Pt电池[1]
上述电池是在较高的温度下使用氧化物样品作为电解质隔膜。氧浓度差电池结构如图3.1所示。
如果实测电动势与通过式(3.1)所示的Nernst's方程计算的理论E0相近,该氧化物可被视作离子导体:
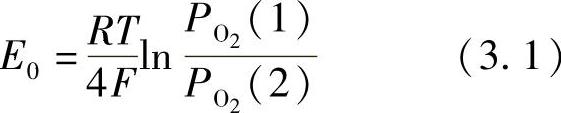
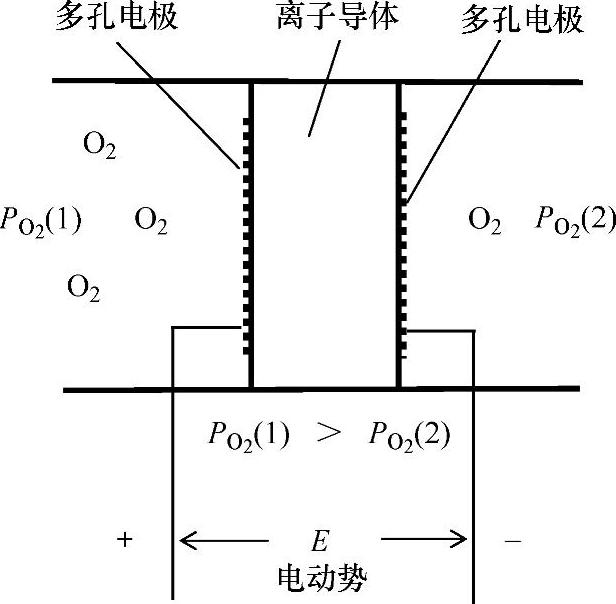
图3.1 电化学氧浓度差电池的概念
如果未能测得电动势,那么该氧化物的载流子可能是电子或者电子空穴。如果电动势数值不为零,但小于根据式(3.1)计算的E0值,该氧化物的导电性可能部分来自离子,而另一部分来自电子。然而,读者应注意这种方法不能确定氧化物中哪种离子是移动的,并且实测值和电动势理论值的比值(E/E0)并非一定能反映出离子转移数目的真正数值。需要用其他实验方式,比如电化学质子交换测定或示踪技术,来确定哪种离子是移动的。
多位研究者使用不同的实验手段和计算模型研究了钙钛矿型化合物中移动离子的传导行为。其中被普遍接受的是基于离子空位跃迁的移动主体离子传递机理,该机理认为容许因子t及晶体的自由体积v是影响离子移动的重要因素。容许因子可用于衡量钙钛矿晶体结构的对称性,表达式为
 (https://www.daowen.com)
(https://www.daowen.com)
式中 rA、rB和rX——ABX3中A、B和X离子的离子半径。
不论从经验角度还是从定量角度来看,良导体钙钛矿型氧化物的t值相对较大。自由体积是一种衡量晶胞内堆积程度的量度,通常用测得的晶胞体积与根据已知离子半径计算出的晶胞内离子体积之和的差异来表示。尽管相关的定量计算尚未结束,但多数情况下,良离子导体的自由体积较大。当然空穴浓度、离子半径及极化率等也是衡量是否具有良离子导电性的因素。以后的章节将进行详细介绍。
正如本节简介部分所描述的那样,因为钙钛矿结构稳定,所以很多钙钛矿型化合物从一定程度上偏离了其化学计量组成。这种偏离导致电子缺陷的形成,比如产生过多的电子或者电子空穴,进一步形成n型或p型电子导电。因此,通常情况下应注意钙钛矿型化合物容易进行电子导电,并且电子导电经常伴随于离子导电。因为电子缺陷浓度受制于A/B及(或)(A+B)/X偏离化学计量比例的程度,所以杂质含量、气氛与温度、电子导电的贡献率均随之变化。
通常,在较高温度下氧化物电解质的电子导电性受空气氛围中氧气分压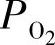 的影响;n型电子导电性σn随着
的影响;n型电子导电性σn随着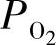 的降低而增加,而p型电子导电性σp随着
的降低而增加,而p型电子导电性σp随着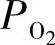 的增加而增加。PO2和σn以及σp的关系如式(3.3)和式(3.4)所示:
的增加而增加。PO2和σn以及σp的关系如式(3.3)和式(3.4)所示:

式中 n——自然数;
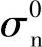 和
和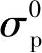 ——常数,不受氧气分压的影响[1]。通常认为,对很多氧化物电解质而言,离子电导率σi本身不受
——常数,不受氧气分压的影响[1]。通常认为,对很多氧化物电解质而言,离子电导率σi本身不受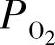 的影响。据此,总电导率σ可表示为
的影响。据此,总电导率σ可表示为
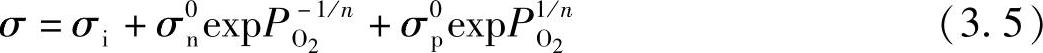
电导率对数值与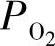 对数值之间的关系如图3.2所示。剖面线填充的区域代表混合导电性占主导地位,这两个混合导电性区之间的区域代表离子导电性占主要地位,在此电子导电性很低,可以被忽略不计。混合导电性区域外侧是电子导电性区域。
对数值之间的关系如图3.2所示。剖面线填充的区域代表混合导电性占主导地位,这两个混合导电性区之间的区域代表离子导电性占主要地位,在此电子导电性很低,可以被忽略不计。混合导电性区域外侧是电子导电性区域。 实验结果将在随后的氧化物离子—电子混合导体部分进行详细介绍。
实验结果将在随后的氧化物离子—电子混合导体部分进行详细介绍。
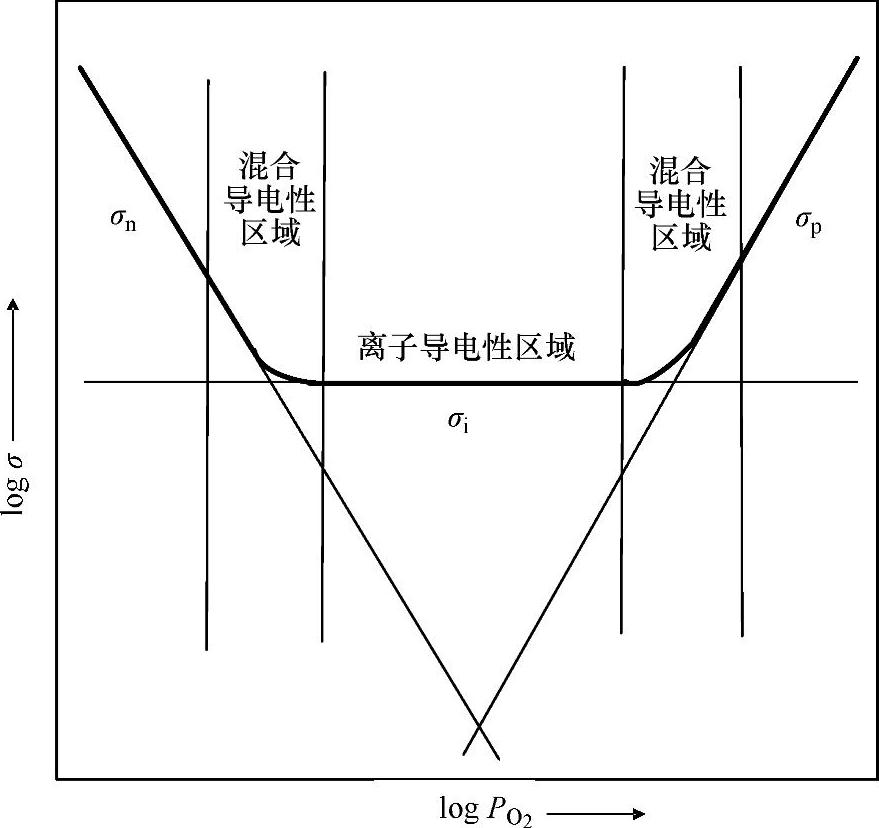
图3.2 导电性与氧分压之间的关系
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







