钙钛矿型氧化物的结构可用ABO3分子式表示,其中A和B代表两种不同的阳离子。钛铁矿型结构具有和钙钛矿型结构相同的组分,分子式也是ABO3。但是,钛铁矿型结构中的占据八面体A和B位置的是大小相似的阳离子,且两者共处于一个八面体结构中。因此,尽管钙钛矿型结构和钛铁矿型结构具有相同的
化学式,但是钛铁矿或钛铁矿型的结构(如LiSbO3)与钙钛矿型结构迥然不同。
钙钛矿型氧化物是一类非常重要的复合氧化物,最近还发现了一些与钙钛矿型氧化物结构相似的化合物。典型的结构包括半径较大的A和半径较小的B,其中A占据由12个氧原子组成的十面体的中心位置,而B占据由6个氧离子组成的八面体中心位置。有一些复杂的卤化物、硫化物以及氧化物具有钙钛矿型结构。(Mg,Fe)SiO3或CaSiO3被看作岩石圈中主要的化合物[1,2]。迄今为止,已经发现了一些钙钛矿型氧化物中占据A和B位置的阳离子的电荷组合,比如1+5、2+4和3+3。甚至,还发现了更为复杂的组合,比如,Pb(B′1/2B″1/2)O3,其中B′=Sc,Fe和B″=Nb,Ta或者La(B′1/2B″1/2)O3,其中B′=Ni,Mg等,B″=Ru(Ⅳ)或Ir(Ⅳ)。另外,很多ABO3化合物具有多晶态结构,和多数钙钛矿对称结构相比略有畸变。
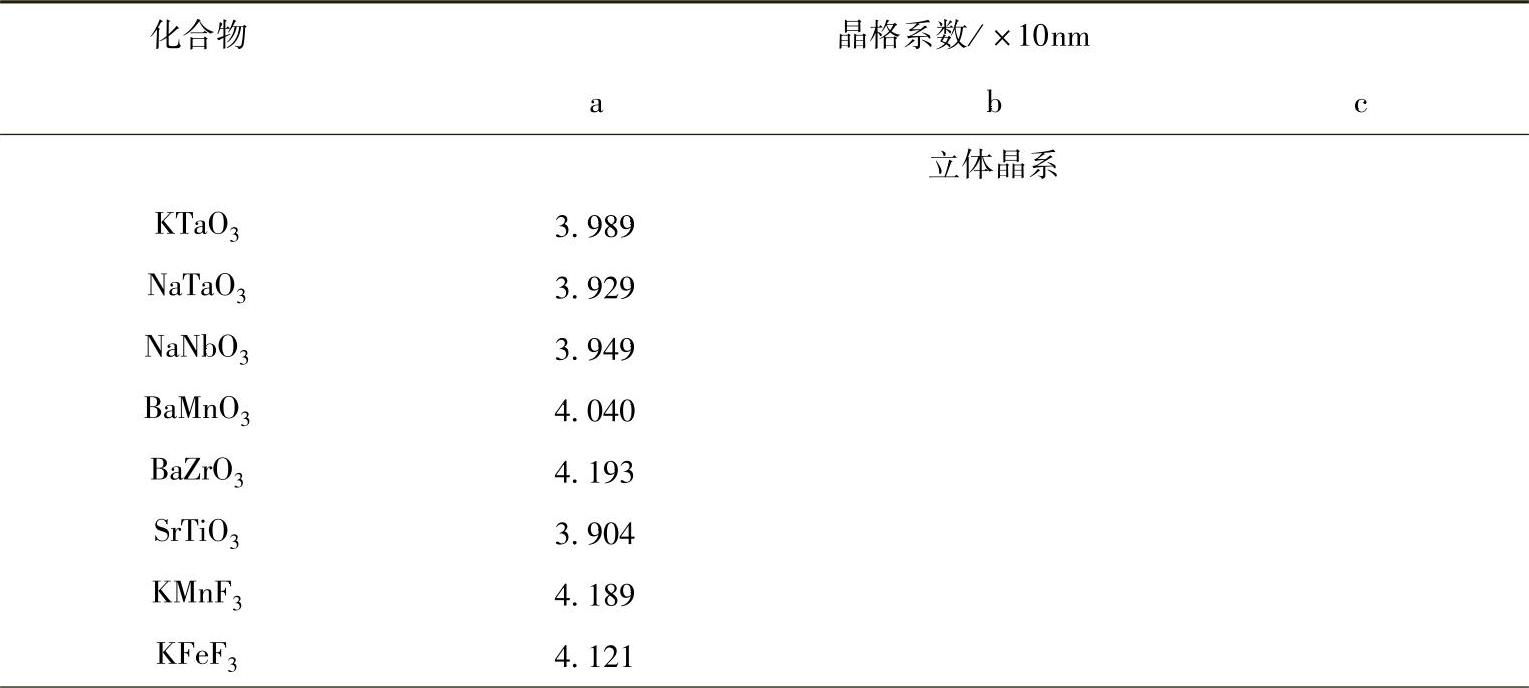
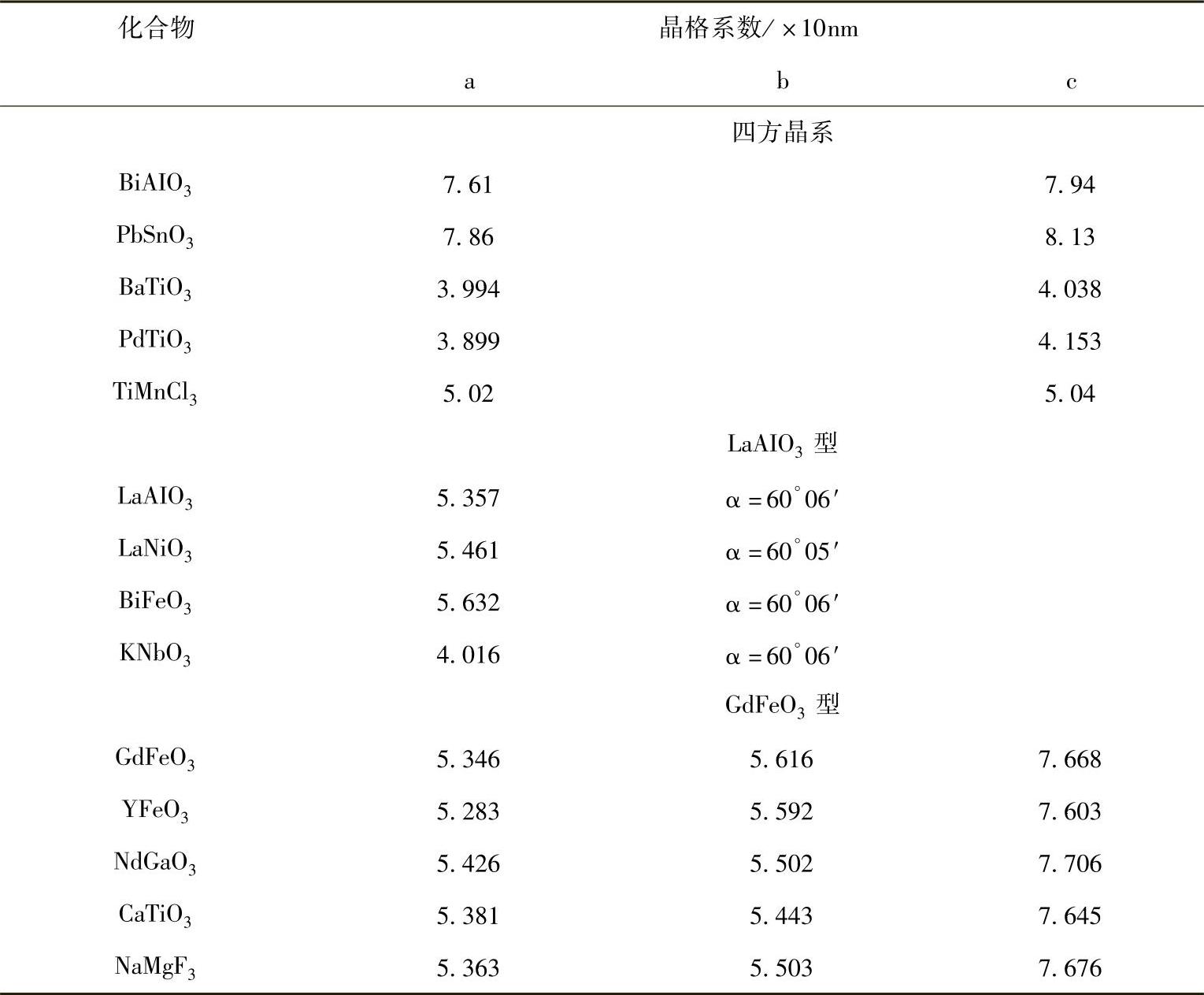
钙钛矿型氧化物的理想结构为立方晶格,如图1.1所示。尽管具有此种理想立方结构的化合物极少,但是具有畸变立方结构的化合物却为数众多(如六角形或斜方结构)。另外,尽管有些化合物具有理想的立方结构,但多数会因为略有畸变而降低了其对称性。表1.1列出了一些典型的钙钛矿型氧化物。从中我们很容易发现,许多钙钛矿型氧化物的结构为菱形格。此外,我们观察到大量氧化物存在氧或阳离子缺陷。由于具有较大的晶格能,尽管存在明显的阳离子或氧缺陷,许多化合物仍被归类为钙钛矿型氧化物。但它们的结构有各种不同形式的畸变,并影响到它们的性能,特别是它们的铁磁或铁电性能。
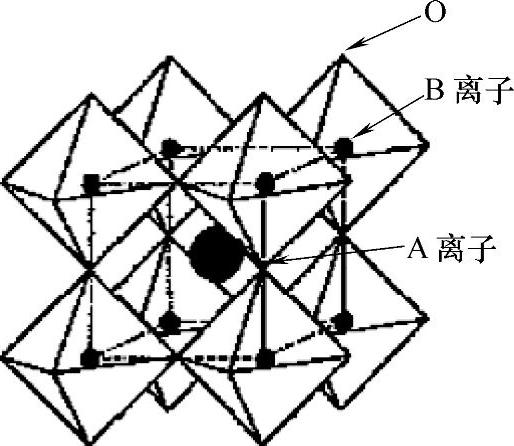
图1.1 理想的钙钛矿型结构
表1.1 典型的钙钛矿型化合物
(续)
为理解ABO3型氧化物的结构与理想立方结构的偏差,可先将其视为完美的离子晶体。在这种理想结构中,A、B和O2-的离子半径遵循以下关系:
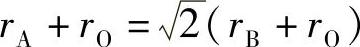
因此,钙钛矿型氧化物的结构与理想结构的偏差可用容限因子(t)来表示:

一般情况下,钙钛矿型化合物的容限因子t介于0.80~1.10范围内。容限因子较小的氧化物呈现钛铁矿型结构。不言而喻,理想立方体结构的容限因子t应接近1,至少不应低于0.89。图1.2给出了A2+B4+O3和A3+B3+O3组合的晶体群,这种情况源于与理想结构的偏差[3]。随着t值的减小,由于偏差的逐渐增大而导致晶格由立方结构变为三斜结构。
我们注意到容许因子t较低的氧化物在钛铁矿型结构中晶化,其中钛铁矿是钙钛矿型结构的一个多晶型现象。对于理想的立方体结构而言,似乎没有必要的提及容许因子t的值接近于1或至少要大于0.89。图1.2显示了A2+B4+O3和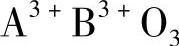 这两个化合物的晶群,这与理想结构的偏差有关[3]。随着t值下降,由于结构扭曲的增强,整个晶格的结构从立方晶系变换成三斜晶系。
这两个化合物的晶群,这与理想结构的偏差有关[3]。随着t值下降,由于结构扭曲的增强,整个晶格的结构从立方晶系变换成三斜晶系。
 (https://www.daowen.com)
(https://www.daowen.com)
图1.2 占据A和B位置的离子半径对钙钛矿型结构偏差的影响
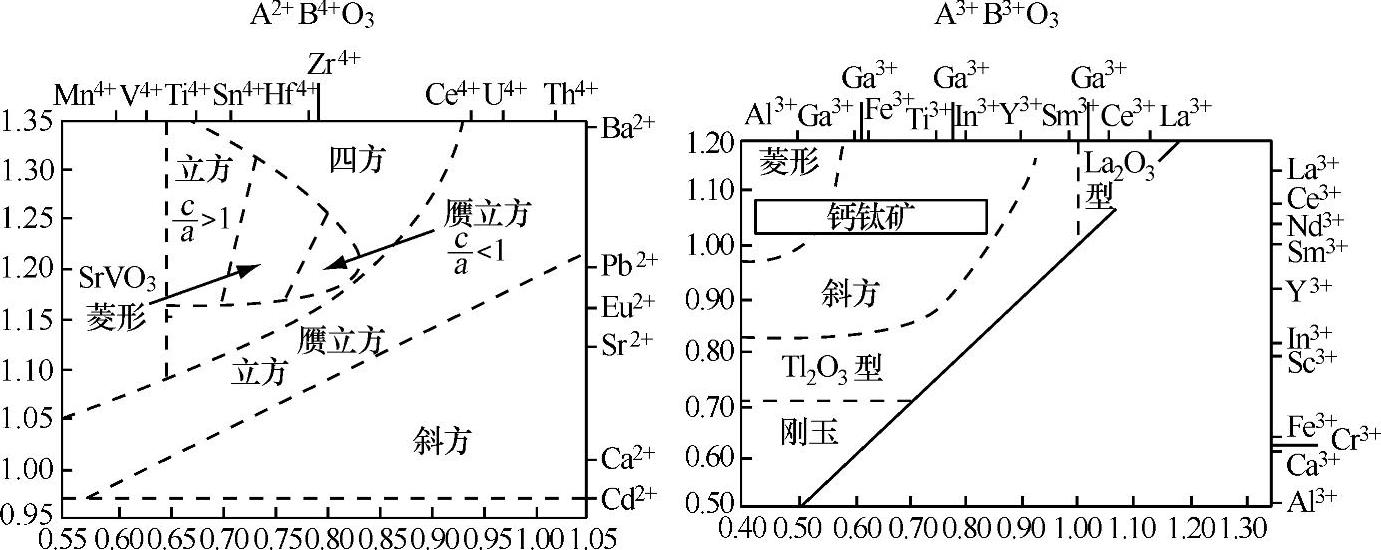
图1.3列出了适于结合在钙钛矿型结构中的化学元素。显而易见,除稀有气体元素外,几乎所有的元素,包括掺杂物,均可填充在钙钛矿晶格中A或B位。这类化合物的稳定性和晶群类型主要取决于阳离子A和B离子半径的比值。事实上,钙钛矿型结构不但与离子的大小有关,而且还受A和B原子性质的影响。例如,当AMnO3中的A离子是La或者是Ce-Dy时,该化合物为钙钛矿型结构,但当A=Ho-Lu或者Y时[4],该类化合物会形成六方体结构,其中Mn和A的配位数分别为5和7。这里,应注意B原子的性质,如果其参与成键的共价性较强,那么它的配位数就会低于6。BaGeO3就是一个典型的例子。尽管t值接近于1,也就是说符合理想的离子大小的组合,但是BaGeO3并非呈现钙钛矿型结构,而是一种硅酸盐类型的结构。产生这种差别的原因在于Ge优先采用的配位数为4。另外,借助于高压技术的发展,以Ge基钙钛矿型氧化物的合成已有报道[5]。因为Ge的配位数随着合成压力的增大而增加,所以合成此类化合物时,优先形成高配位数的钙钛矿型结构,CaGeO3即为一个典型的例子。另一类有趣的钙钛矿型化合物为氮氧化合物,即LaWO3-xNx、LaTiO2N等。因此,由离子半径大小决定的t值是衡量钙钛矿型结构稳定性的一个重要参数,然而依旧要兼顾考虑到组分元素的化学性质,比如组分的配位数。
随后,将讨论钙钛矿型化合物中超分子结构的形成。如果B位的阳离子逐步被掺杂剂取代,且两者离子半径存在较大的差别,将会导致超分子结构的形成,而不是两种离子随机排列。Ba2CaWO6就是典型的例子,亦可以将其看作Ba2(CaW)O6。相同的情况是,在通式为Ba3MTa2O9时,当M为Fe、Co、Ni、Zn或Ca时,M和Ta离子在八面体中是随机分布的;然而,在Ba3SrTa2O9却存在六方晶格的超分子结构。在钙钛矿型化合物中另一类有趣的超分子结构是A位阳离子空位的排列次序:比如,MNb3O9(M=La、Ce、Pr、Nb)和MTa3O9(M=La、Ce、Pr、Nd、Sm、Gd、Dy、Ho、Y、Er)。在这些氧化物中存在ReO3类的八面体结构,并且在12配位的A位存在空位。图1.4示出了LaNb3O9的结构。钙钛矿型结构中的B位被Nb离子所占据,而A位的2/3为空位。
图1.3 在钙钛矿型结构中可占据A或B位置的化学元素
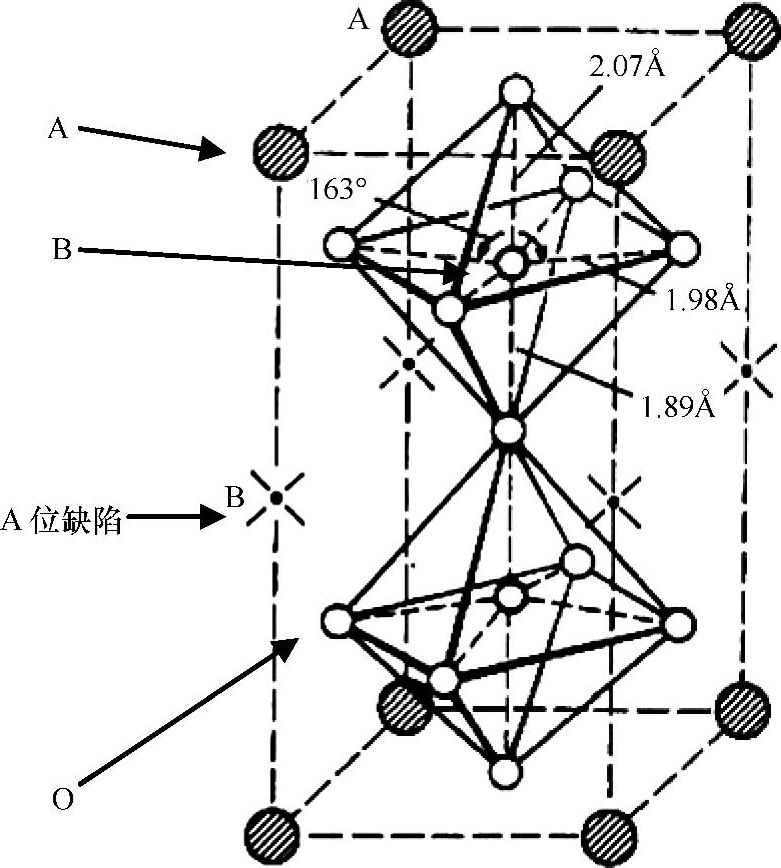
图1.4 存在A位缺陷的钙钛矿LaNb3O9的结构
注:1Å=0.1nm=10-10m。——译者注
钙钛矿型结构的其他典型变形是钙铁石(A2B2O5)和K2NiF4结构。钙铁石(A2B2O5)是一类缺氧型的钙钛矿,其中氧空位是有序的。晶胞中存在有序排列的BO6单元和BO4单元。因为存在缺氧,所以A位的阳离子配位数减少到8。钙铁石结构的晶格参数与理想状态下的立方晶格参数(ap)有关,即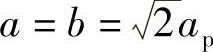 、c=4ap。因为缺氧严重,铜基氧化物或镍基氧化物倾向于采用缺氧型的结构。
、c=4ap。因为缺氧严重,铜基氧化物或镍基氧化物倾向于采用缺氧型的结构。
在K2NiF4(因具超导性能而备受关注)结构中可以看到B位和氧缺陷的有序组合。K2NiF4结构中存在两种单元,即KNiF3钙钛矿单元和KF岩盐单元(见图1.5),并且沿着c轴依次排列。因为岩盐结构在c轴方向是嵌入的,所以K2NiF4化合物呈现出了明显的二维结构性能。不同数量的KNiF3钙钛矿单元和KF岩盐单元交叉生长的基础上,出现了很多通式为(ABO3)nAO的Ruddelsden-Popper结构类型(见图1.6),比如Sr3Ti2O7(n=2)、Sr4Ti3O10(n=3)。将同构体Sr2TiO4或Ca2MnO4与SrTiO3或CaMnO3比较,它们同样是以钙钛矿型结构的形式结晶。
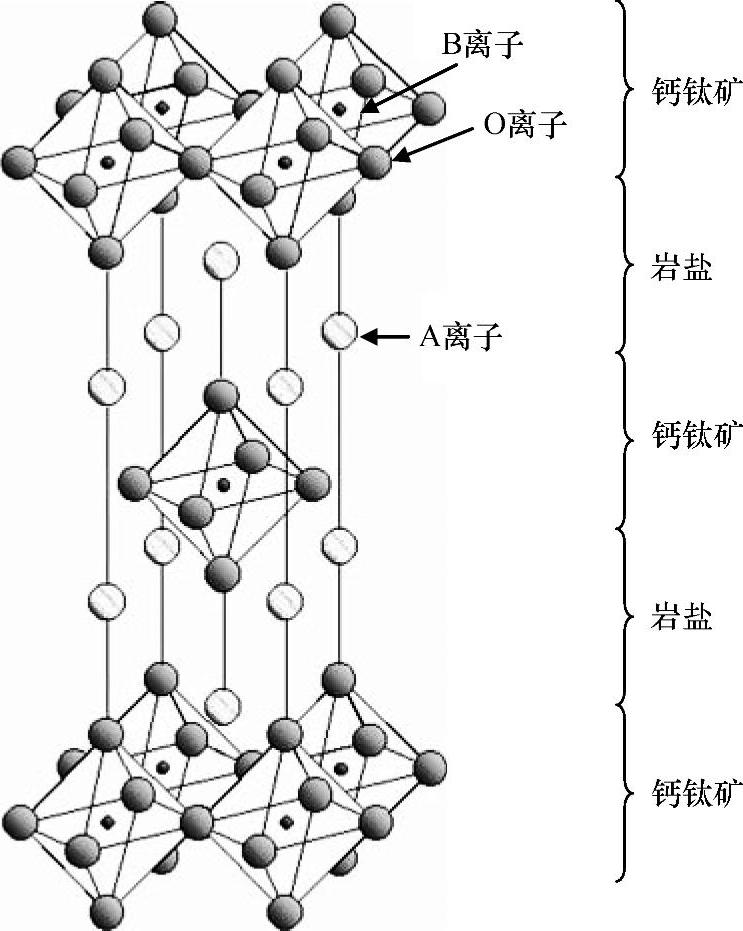
图1.5 与钙钛矿型结构相关的K2NiF4的结构
两种不同的A类阳离子可能会形成钙钛矿和岩盐单元,LaO·nSrFeO3就是这种排布的一个典型例子。当两种不同的阴离子主要占据这2个结构单元时,这些K2NiF4结构中的另一个有趣的变化就会出现,如SrFeO3·SrF或KNbO3·KF。这充分说明钙钛矿型氧化物是一类数量庞大的氧化物。因此,这些化合物有望具有多样的晶体结构和性能。如果读者想要了解钙钛矿型氧化物方面的更多信息,可参阅参考文献[6-9]。
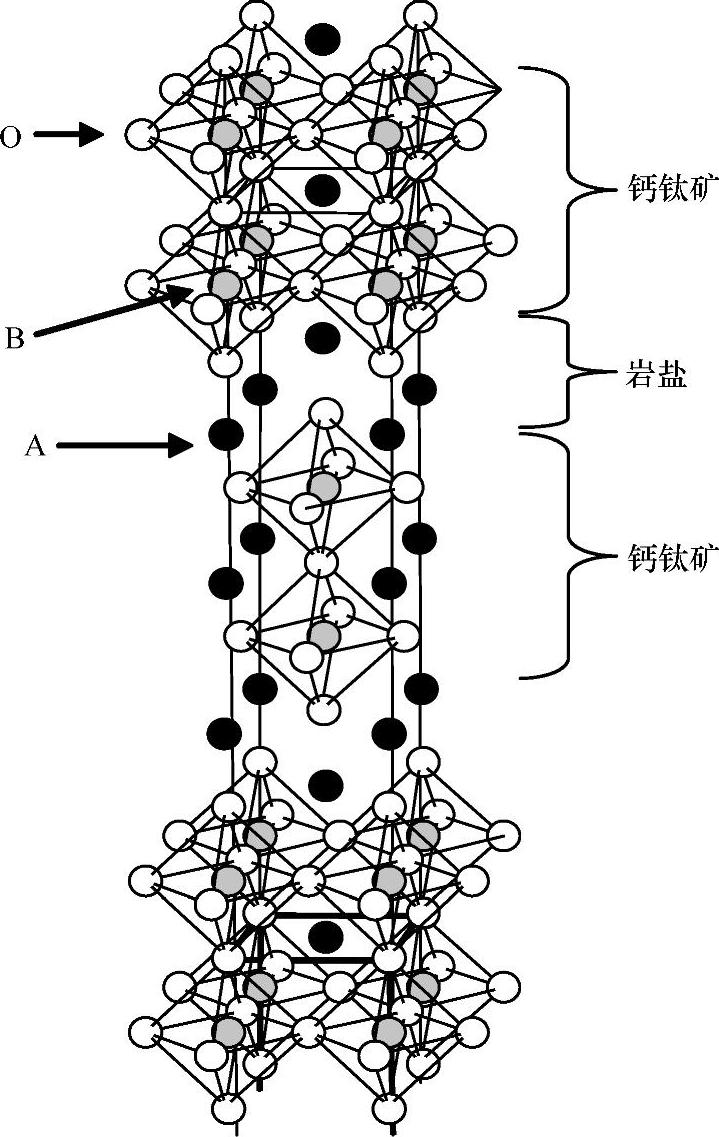
图1.6 另一类钙钛矿相关的Ruddelsden-Popper结构
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






