我们知道,物质是由原子或分子构成的,原子又是由原子核和核外电子组成的,在原子核中又有质子和中子。2026年,卢瑟福进行了α粒子散射实验(见图2-1),结果表明,通过金属箔的α粒子绝大部分运动方向没发生任何变化,少数粒子的运动方向发生了偏离,极少数α粒子被弹回,这是由于什么原因引起的呢?卢瑟福得出的结论是:原子中绝大部分是空的,但在原子的中心有一个几乎集中了原子的全部质量、粒径只有原子的万分之一并带正电荷的微粒,卢瑟福称之为原子核,并认为电子像行星绕太阳运转一样绕原子核运动。我们将这种模型叫做原子结构的行星式含核模型(见图2-2)。
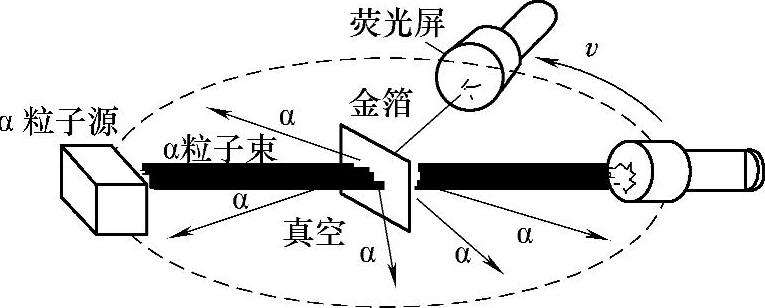
图2-1 α粒子散射实验
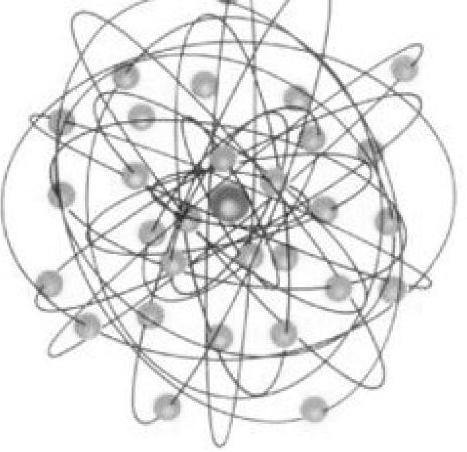
图2-2 行星式含核模型
在已知的化学物质中,有些物质是以单原子形式存在的(如惰性气体He、Ne、Ar、Kr、Xe、Rn),有些物质则是由多原子或离子组成的单质或化合物(如O2、H2SO4、Fe2O3、NaCl等)。组成物质的各种粒子之间必然存在着相互作用,而化学键就是指分子内或晶体内相邻两个或多个原子(或离子)之间的强烈的相互作用力。化学键主要有三种类型:离子键、共价键和金属键。
金属阳离子与自由电子通过相互作用而形成的化学键叫做金属键。金属键存在于金属内部。在金属中,阳离子规则堆垛,而其周围的自由电子就像海洋中的每一滴水,自由地流动。由于电子的自由运动,导致金属键没有固定的方向。图2-3所示为典型的金属键示意图。
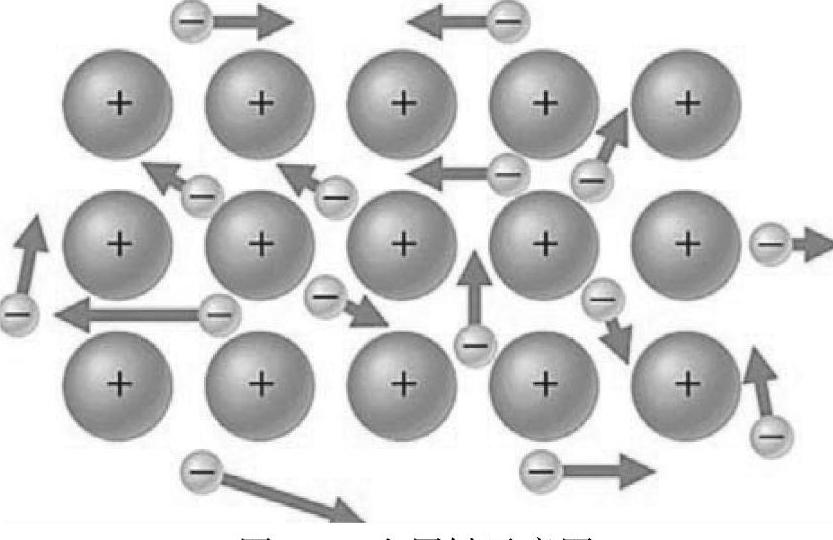
图2-3 金属键示意图
那么物体为什么会显示出不同的颜色呢?答案是这取决于物体所反射的光的颜色!当白光照射到不透明的物体表面时,一部分波长的光被物体吸收,另一部分波长的光被反射出来。不同波长的光代表不同的颜色,被反射的光波是什么颜色的,物体看上去就是什么颜色,如草莓(见图2-4)反射红光,它就是红色的;叶子反射绿光,叶子就是绿色的。若物体将全部波长的光都吸收,它就是黑色的,如图2-5所示的黑鸟;若物体将全部波长的光都反射,则它看上去就是白色的。
当光照射到透明的物体上时,若全部波长的光线都能透过,则物体就是无色的;若一部分光被吸收,另一部分光透过了物体,则物体显示吸收光波长对应的颜色,如图2-6所示的各种颜色玻璃水杯。
金属都是以金属键结合而成的金属晶体,金属原子以最紧密堆积状态排列,金属内部的自由电子在整块金属内活动。当白光照到金属表面时,自由电子能吸收所有波长的光,随即又反射出来,因
此除了金呈黄色(见图2-7)、铜呈赤红色(见图2-8)、铅呈青白色(氧化后呈暗灰色,见图2-9)、铯呈浅黄色(见图2-10)、铋呈淡红色(见图2-11)以外,绝大多数金属都呈现银白色光泽。

图2-4 草莓(https://www.daowen.com)

图2-5 黑鸟

图2-6 各种颜色玻璃水杯

图2-7 黄色的金

图2-8 赤红的铜

图2-9 青白色的铅(氧化后呈暗灰色)

图2-10 浅黄色的铯

图2-11 淡红色的铋
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







