在铜管上取样,分别在日用自来水和5%(质量分数)NaCl水溶液中进行恒电位极化曲线测试。测试面为管内表面,试样暴露在介质中的面积为1cm2,其余部分用环氧树脂封涂。用恒电位暂态方法测试试样的电化学阳极极化和部分阴极极化曲线,电位间隔为20mV,每一电位下的稳定时间是3min。参比电极为饱和甘汞电极,辅助电极是Pt片,测试仪器为PS-1型恒电位/恒电流仪。应用Tafel直线法确定腐蚀电流密度,以此来对比各管在两种介质中的腐蚀速度以及NaCl对铜管腐蚀的影响。各条件下测得的腐蚀极化曲线(恒电位极化曲线)如图8-55所示。
从图8-55可以看出,试验的白铜在两种介质中的腐蚀电化学行为过程相似,但不完全相同。在较低的极化范围内,铜管在自来水和5%NaCl水溶液中均处于活化极化状态,随着极化过电位的增加,极化电流密度不断增加。当极化过电位达到100~150mV时,腐蚀过程趋缓,铜管的腐蚀开始出现钝化状态。盐水中的铜管的钝化趋势比自来水中要明显一些,但其维钝电流密度却比水中大得多,而且即使进入钝化段,其腐蚀过程也不稳定,NaCl对腐蚀试样表面的作用同时显示在极化曲线的波动上。在自来水中,白铜管的腐蚀电位约为+100~+200mV;在5%NaCl水溶液中,铜管的腐蚀电位变负,变为-100mV。腐蚀速度比在自来水中明显增加,达到5~8倍。从腐蚀电位和腐蚀电流密度可以明显看出,铜管在盐水中的耐蚀性已经明显下降。
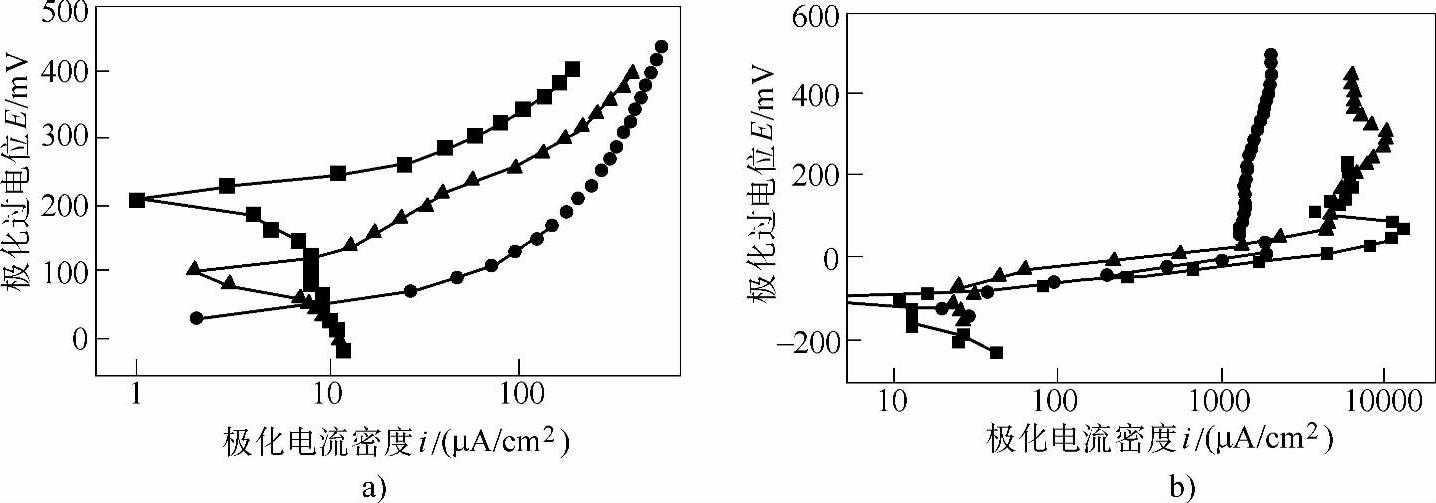
图8-55 腐蚀极化曲线(https://www.daowen.com)
a)日用自来水中 b)5%NaCl水溶液中
■—未使用管 ▲—未使用管(库存) ●—运行管
另外,使用管和未使用管的腐蚀速度表现出一定的差别。在自来水中,由于水的腐蚀性较弱,铜管表面缺陷(腐蚀造成的不均匀和黏附残余附着物)引起的腐蚀差别是很明显的。使用管的腐蚀电位比未使用管低100~200mV,腐蚀电流则高1倍以上。在5%NaCl水溶液中,由于盐水的腐蚀性较强,因此这一差别不明显,管的腐蚀电位和腐蚀电流密度相差不大。使用管与未使用管的差别只有管表面的状态,显然使用管表面的原有附着物促进了试验条件下铜的腐蚀。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






