在分析了独立原子中的电子能级后,非常有必要来分析两个原子组成共价键的机制和能级的分布,这是用于半导体材料分析的重要基础。
仍然使用氢原子的玻尔模型进行推广,图2-5a是两个孤立的氢原子核的电子能量示意图。所谓孤立,是指两个原子核距离足够远,不会相互影响。两个孤立原子核的电子能级是一样的,与上一节的计算结果相同。可以看到,电子的能量是量子化的。如果允许两个原子核相互靠近,根据库仑定律,一个电子将会受到两个原子核的作用,则电子的势能为

式中 ra、rb——电子和两个原子核的距离。
图2-5b给出了允许的电子能级,其仍然是量子化的。注意到在基态(最低能态)的电子会被束缚在某一个原子核的周围,形象地说位于两个陷阱中的其中一个,而处于激发态的电子会在两个原子核之间往返运动,即在两个陷阱中往返,从效果来看,是为两个原子所共有。由于电子总是趋向于寻找可能的最低能量,因此这种处于某一个较高能级的状态不会持久,电子会很快回到基态。
如果原子核的间距足够小,核间的势能最大值可以小于电子的基态能量,图2-5c所示为这种情况下的能级图。此时,即使是处于基态的电子也会被两个原子核共有,在基态的两个点之间振荡。(https://www.daowen.com)
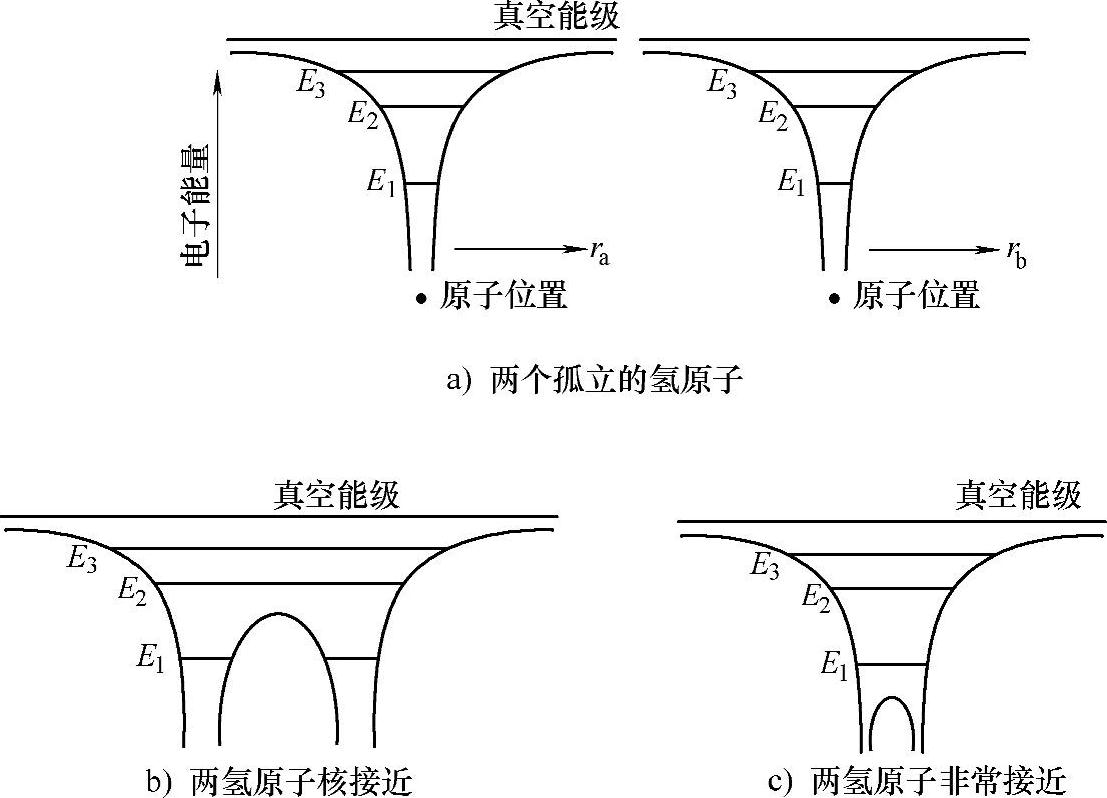
图2-5 不同距离下两氢原子的电子能级
由于每一个原子核都有一个基态,那么一个中性的氢分子(H2)就允许两个电子占据基态。虽然第二个电子的存在会改变静电力,从而轻微地改变能级结构,但结果是两个电子仍然会在图中所示的区域内振荡。在两个原子核中间的区域,电子的动能很小,因此速度也很小。电子在这个区域运动很慢,或者从平均意义上说,电子大部分时间都处在两个原子核的中间。因此,电子在该区域形成带负电荷的“电子云”,将两个原子核吸引在一起。但是,如果核间的距离太小,势能就会减小,由于总能量E守恒,电子的动能和速度增加,电子云的作用减弱,对原子核的吸引力减小。在某一个特定的间距,电子云产生的核间束缚是稳定的,就形成一个稳定的氢分子(H2)。这种形成分子的机制就是共价键。
前面说过,电子具有4个量子数,其中n是主量子数,主要决定了电子的能量,其他3个量子数对电子的能量也有影响,但是影响都很小。根据泡利不相容原理,在一个相互作用的系统中,两个电子不能具有完全相同的一套量子数。
例如,在原子的最低能量轨道,n=1,这个状态可以容纳2个电子。这两个电子具有不同的自旋量子数。同样地,在第二壳层中,最多可容纳8个电子。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





