气化反应涉及炭和气化介质之间的多个反应在表2.1中已列出。在本书所建立的热力学平衡模型中进行一定的简化,只选择表2.1中最主要的几个气化反应:
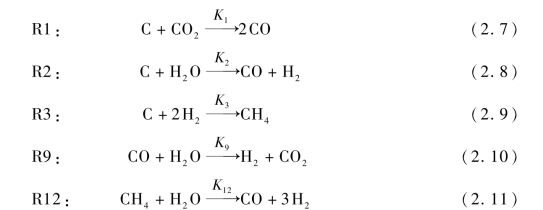
式(2.7)~式(2.11)显示了CO2和水蒸气等气化剂如何与固体碳反应,将碳转化为低分子量气体,如CO和H2,以及CO、CH4等气体与气化剂(蒸汽)之间发生的反应。这些反应通常是吸热反应(如R1和R2),但是它们中的一些也可以是放热反应(如R3)。
式(2.7)~式(2.11)中的Ki为反应平衡常数。该参数主要与气化温度有关,而与气化压力无关。图2.5给出了该模型中所应用到的主要气化反应的平衡常数与气化温度的关系。正对应不同的气化反应,现分析如下:
R1:碳的气化反应(Boudouard Reaction)是指碳在CO2中的气化,它是气化过程中最重要的反应之一,当反应温度低于850℃时,其逆向反应速度很快,因此CO2很难被还原为CO;当反应温度高于850℃时,其正向反应将加快并超过逆反应速率,产物CO将迅速增加;当气化温度超过1 200℃时,逆反应速度变得极为缓慢,反应基本都是朝着正反应方向进行,CO2能全部反应生成CO,所以要提高产物中CO的浓度,可通过升高气化反应温度的方法来实现。
R2:水煤气反应(Water Gas Reaction)是气化反应中最重要的反应。随着气化温度的升高,正反应得以加强,气化反应温度越高,则平衡常数也越大,所产气体中H2和CO的浓度也会越高,所以在气化过程中为了提高H2和CO的浓度,需要尽可能高的气化反应温度以促进水煤气反应朝正反应方向进行,并且气化温度不能低于750℃,否则水煤气反应的逆反应将会超过正反应,导致H2和CO浓度降低。
R3:加氢气化反应(Hydrogasification Reaction)是提高所产气体热值的重要反应。由图2.5可知,随气化温度的升高,加氢气化反应的逆反应会被加强,不利于甲烷的生成,但是气化温度太低也会影响H2的含量,该反应的平衡态在800℃。

图2.5 各气化反应的反应平衡常数与气化温度的关系
R9:水煤气变换反应(Water Gas Shift Reaction)以消耗CO为代价增加了气化产物的氢含量,这是制取富氢燃气的重要反应。该反应在较低温度下具有较大的反应平衡常数,这意味着在较低温度下H2的产率较高,在225℃左右获得最佳产量。随着温度的升高,逆反应加强,H2的产率降低,但反应速率增加。在1 000℃以上时,水煤气变换反应能迅速达到平衡,但在较低温度下,它需要非均相催化剂进行催化才能达到平衡,因此,为了通过该反应增加气体中H2的组分,需要将气化反应温度尽可能降低。
R12:蒸汽重整反应(Steam-reforming Reaction),该反应是气化过程中调整CH4含量的重要反应,与加氢气化反应不同的是该反应为均相反应,随着温度的升高甲烷含量呈下降的趋势,所以为了增加气体热值应该控制气化反应温度,应抑制该反应的正反应的发生。
焦炭气化反应总方程可以描述为:
![]()
其中a为燃烧后残余的焦炭的物质的量;m为水碳比(Steam/C);xc,i为各产物的物质的量。若要求解以上方程,则需根据元素守恒原理建立平衡方程。
碳平衡方程:(https://www.daowen.com)
![]()
氢平衡方程:
![]()
氧平衡方程:
![]()
由于元素守恒方程为3个,未知数为5个,需要增加两个反应平衡方程。
反应R3的反应平衡方程为:
![]()
其中Kc,3为反应R3的反应平衡常数,可由式(2.17)求得:
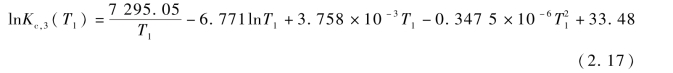
反应R9的反应平衡方程为:
![]()
其中Kc,9为反应R9的反应平衡常数,可由式(2.19)求得:
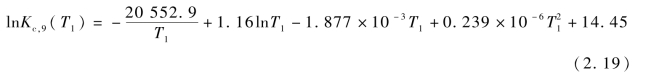
其中T1为焦炭气化温度(K)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






