根据开尔文公式:

式中,pr是半径为r的液滴或气泡的蒸气压;p为平液面的蒸气压;γ为液体表面张力;M为液体相对分子质量;ρ″为液体密度;R为摩尔气体常数;T为热力学温度。凸液面的r>0,pr>p,即液滴等凸液面的饱和蒸气压大于平液面的饱和蒸气压;凹液面的r<0,pr<p,即凹液面(如气泡)的饱和蒸气压小于平液面的饱和蒸气压。因此,毛细管内的蒸气容易凝聚成液体。虽然以上情形针对的是液体,但开尔文公式对固体,尤其是高温下容易挥发的物质,如PbO、BeO仍然适用。
图10.5中,接触颈为凹面,其曲率半径ω为负;其他部位为凸面,曲率半径r为正。颈部凹面处的蒸气压p1用开尔文公式表示为

式中,p0为平表面蒸气压;γsv为粉末的表面能;ρ‴为密度;其余符号的意义同前。
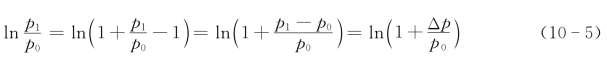
根据数学知识,当x很小时,ln(1+x)≈x。在式(10-5)中,压差Δp很小,故ln(p1/p0)≈Δp/p0。又因为接触颈半径x≫ω,所以式(10-4)可简化为

式(10-6)表明Δp=p1-p0<0,即原子在接触颈凹面处的蒸气压小于平表面的平衡蒸气压。同理也可得出,原子在接触颈凸面处的蒸气压大于平表面的平衡蒸气压,故原子在粉末颗粒凸表面处蒸发,而在凹面处凝聚,从而使颈部逐渐被填充,如图10.6所示。
凸面原子蒸发产生的气态物质在凹面凝聚,该情形可近似地用固体对气体吸附的Langmuir方程描述。这样可得出气态物质在单位时间、单位面积上的凝聚速率v与压差Δp的关系:
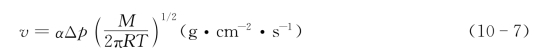
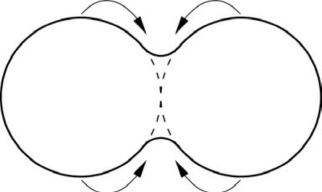
图10.6 蒸发-凝聚起始阶段示意图(引自Kingery,2010)(https://www.daowen.com)
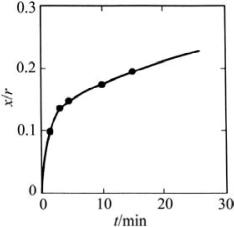
图10.7 725℃时,NaCl球形颗粒颈部长大曲线(引自Kingery,2010)
其中α为调节系数,α≈1。单位时间内,物质在颈部的凝聚量等于颈部物质体积的增加速率时,有:
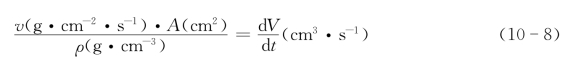
为使读者清楚式(10-8)的意义,我们引入了各量的单位,并将单位置于括号内。
图10.5(b)中,x/r<0.3时,接触颈半径ω≈x2/(2r),接触颈透镜(图10.6中虚线所示)表面积约为A=π2x3/r,接触颈体积约为V=πx4/2r。将这些近似值及式(10-6)和式(10-7)代入式(10-8),整理、积分后得
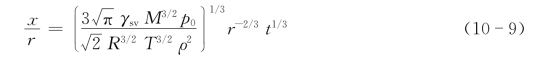
上式是Kingery等用双球模型推出的。它表明了颗粒间接触面的半径和影响其生长速率的变量(r,t,p0)之间的关系。若把式(10-9)中的括号部分和r看作是常数的话,则接触颈的生长x/r随时间t的变化如图10.7所示。
图10.7表明粉末接触颈在烧结初期增长较快。随着烧结时间的延长,接触颈的增长逐渐减缓,而延长烧结还会带来后续晶粒生长等问题。因此,企图采用无限延长时间来促进致密化是不可取的。式(10-9)还表明,粉末起始粒径r小,则接触颈增长快,这可促进粉末的致密化。而粉末起始粒径r和烧结时间t是两个在粉末体烧结时容易控制的参数。
采用蒸发-凝聚传质时,原子从粉末凸面蒸发,在凹面处凝聚。在此过程中,粉末颗粒的中心距并未受到蒸发-凝聚传质的影响,即烧结时,粉末坯体不产生收缩。NaCl在750℃烧结时没有发生收缩表明了蒸发-凝聚具有一定的合理性。
蒸发-凝聚需要物质具有可观的蒸气压。对微米级颗粒而言,蒸气压的数量级要大于1.01~10.13 Pa。然而,大多数氧化物、金属和硅酸盐等固体物质在高温下的蒸气压都低于这个值。因此,这些蒸气压很低的粉末,其烧结致密化主要不是由蒸发-凝聚机制引起的气相传质,而是由粉末体内的质点扩散引起的。这类扩散传质主要有体积扩散、表面扩散、晶界扩散和位错扩散等。
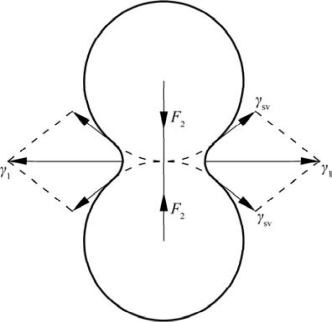
图10.8 粉末双球模型中的应力示意图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







