CaO-Al2O3SiO2相图是一类重要的相图(图8.97)。它在硅酸盐制品、高炉矿渣和矿物岩石中有所应用,尤其是在硅酸盐工业中有很大的实际应用价值。
1.相图简介
本系统除浓度三角形的三种组元外,还有10个二元化合物、2个三元化合物(表8.1)。
表8.1 CaOAl2O3SiO2相图中的化合物及其性质
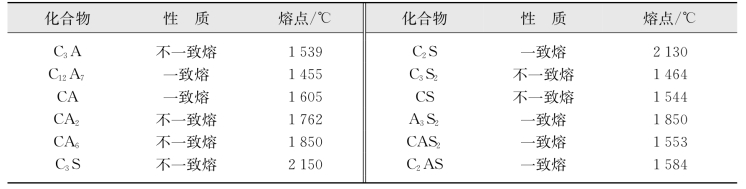
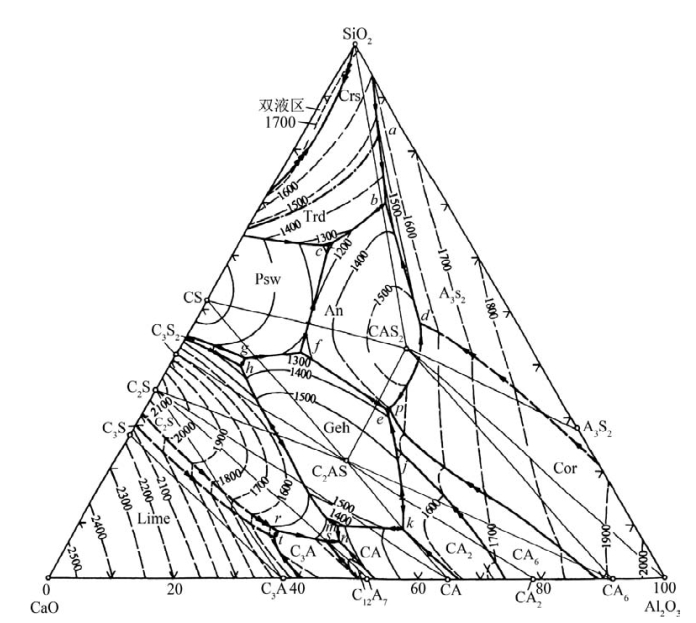
图8.97 CaO-Al2 O3 -SiO2投影状态相图(图中Lime为CaO,Crs为方石英cristobalite,Trd为鳞石英tridymite,An为钙长石anorthite,Geh为钙铝黄长石gehlenite,Cor为刚玉corundum,Psw为假硅灰石pseudo-wollastanite)(引自刘玉芹,2011)
该系统有16个无变量点,其中有一个无变量点(图8.97中靠近SiO2的a点)是方石英与鳞石英的转变点。该转变点没有对应的副三角形。因此,该系统的相图实际只有15个副三角形。
各界线温度的降低方向如图8.97所示。图8.97与我们在前面介绍的基本类型相比,增加了等温线条,而且无变量点又多。这些因素使得实际相图显得比较复杂。但我们在应用的时候,往往只用到其中的一部分。比如,普通硅酸盐水泥,主要运用的是靠近CaO的富钙部分。下面我们以富钙部分为例介绍该相图在水泥生产中的一些应用。图8.98为CaO-Al2O3SiO2相图富钙部分的放大图。
2.硅酸盐水泥的配料
普通硅酸盐水泥熟料含有四种主要矿物晶相:C3S、C2S、C3A和C4AF。根据三角形规则,配料点落在哪个副三角形,则最后的平衡结晶产物就是这个副三角形三个顶点所示的三种晶相。
图8.98中的1配料点处于CaO-C3S-C3A构成的副三角形中,因此其平衡结晶产物有CaO存在。但若配料中CaO过多,则在发生化学反应时,会有部分CaO不能化合成C3S等矿物。这部分没有化合的CaO称为游离CaO(f-CaO)。游离CaO不仅水化速率小,而且它在水化成Ca(OH)2时,体积膨胀达97.9%。这会影响水泥的安定性(soundness of cement),也即在硬化水泥制品内部有局部膨胀应力产生,进而变形、开裂。因此在配料时,CaO的质量分数具有一定的极限。这个极限在相图中称为石灰极限线。理论上的石灰极限线在C3S-C3A线上。配料在这条线的右边,结晶产物无CaO出现。但实际上,生产过程达不到平衡状态,因此开始析出的CaO有可能不能完全被回吸而成为游离CaO,所以实际生产中,人们常将石灰极限线向右移动了一点,即C3S-P2线。配料点通常在C3S-P2线的右上部分。(https://www.daowen.com)
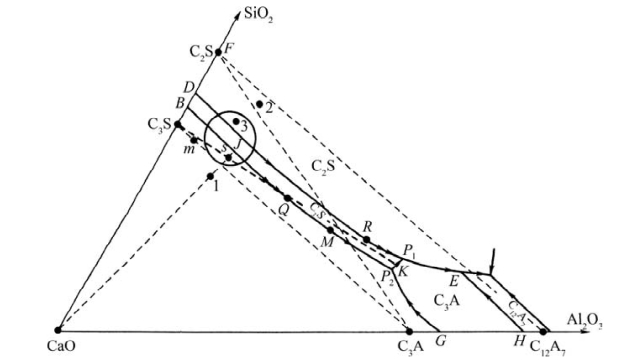
图8.98 CaO-Al2O3-SiO2系统富钙部分的相图(引自宋晓岚,2006)
2配料点处于C2S-C3A-C12A7构成的副三角形中,其平衡结晶产物有C12A7存在,而无C3S。C12A7与水反应迅速、水化的发热量大,而且水化产物的强度不高,因而在普通硅酸盐水泥中不宜含有C12A7。
普通硅酸盐水泥熟料中应含有C3S、C2S等矿物晶相。C3S水化后的早期强度高、强度增进率大,28天强度可以达到一年强度的70%~80%。在四种主要晶相中,C3S水化后的强度最高。硬化水泥浆体的性能在很大程度上取决于C3S的水化作用。因而,硅酸盐水泥熟料中,C3S的质量分数在50%左右,有时甚至高达60%。C2S水化较慢,早期强度较低。但28 d以后,强度有较快增长。一年后的强度可以赶上C3S。而C3A水化迅速、放热多,早期强度较高,后期强度几乎不增长。
综合以上因素,普通硅酸盐水泥的配料点常常在图8.98中的小圆圈内。当然,生产特殊用途的硅酸盐水泥,要选择合适的熟料组成。比如,用于紧急施工的快硬水泥需要较高的早期强度,因而宜适当地提高熟料中的C3S或C3A的量。
3.烧成
以上是从平衡结晶的观点来分析配料点产生的熟料晶相。实际的工艺中,人们是不可能将配料加热到完全熔融,再平衡结晶的。在升温过程中,只是部分配料熔融。因此,除了液相结晶产生熟料矿物以外,固态组分间的化学反应在形成熟料矿物方面也起着重要作用。
C3S往往是在较高的温度下形成的(1450℃)。而液相的出现及液相量对C3S的形成有一定的帮助。理论上,配料点在C2S-C3S-C3A构成的副三角形中。液相出现在图8.98中P1点(1455℃)。但由于C12A7、C3A和C2S在1200℃以下就可通过固相反应较快地形成,加上配料中含有Na2O、K2O等氧化物,故温度在1250℃左右时,液相就会出现。这样C12A7、C3A和C2S和液相达成平衡,其对应的无变量点在E点。当C12A7完全熔融后,液相沿EP1线向P1移动。在此过程中,C3A和C2S溶于液相且液相量增加。这为C3S的形成创造的条件,因为液相的形成可促使生成C3S的反应速率大大增加(C2S+CaO—→C3S)。
4.冷却
为了防止高温下形成的C3S在P1点发生包晶反应而减少(L+C3S—→C2S+C3A),以及β-C2S发生晶型转变,工艺上常采取快速冷却的措施。快速冷却会影响熟料的组成。比如,冷却速率超过熔体的临界冷却速率时,液相失去结晶能力而成为玻璃相且C3S来不及转变而保留下来。
此外,若冷却速率不足以使液相成为玻璃,则液相可单独作为高温熔体而析晶,不受系统中其他相的制约。这种现象特别容易发生在包晶点处。图8.98中P1点在平衡结晶时有包晶反应L+C3S—→C2S+C3A。生成的C2S和C3A把C3S包覆起来,这阻止了液相和C3S的进一步作用。这样,液相会单独作为一个熔体独立结晶,并沿界线P1E移动。到达E点后,C12A7开始析出。因此,虽然配料点对应的结晶结束点在P1,但由于液相独立结晶而使熟料中含有本不应有的矿物C12A7。
由上述可见,无论是在急冷还是液相独立结晶过程中,C3S发生包晶反应的量并不多。因此,对某些硅酸盐水泥的配料系统来说,快速冷却可增加C3S的量。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







