
图8.17 具有低共熔点的二元相图(L表示液相)
将一种组分添加到另一种纯组分中所构成的系统,其熔点或凝固点降低,如图8.17所示。该系统处于液态时,组元以任意比例互溶。降温时,组元的晶相各自从液相中结晶,且在固态时完全不互溶、不形成固溶体。此外,组元间还不发生化学反应。这种相图是最基本的,往往也是许多复杂相图的一部分,故有必要深入学习。我们先来识别相图中的区域、线和点的含义。
1.区域
施加于凝聚态系统的压力通常恒定且不考虑气体的影响,故相图的高温区是液相区。图8.17中,aEb线以上的区域是液相单相区。该区的P=1,F=2,即温度和组成这两个独立变量。
aEG为晶体A与液相L的共存区;bEH为晶体B与液相L的共存区;GH线以下为晶体A与晶体B的共存区。这三个区域的P=2,F=1,即温度为独立变量。
2.线
aE为液相线,表示A与L共存。系统在冷却时,首先在该线上出现晶体A。bE为液相线,表示B与L共存。系统在冷却时,首先在该线上出现晶体B。以上两条线的P=2,F=1,独立变量为温度。GH为固相线,表示A、B与L共存。该线也是系统冷却时,熔体结晶结束线。该线上P=3,F=0。
3.点
a点为A的熔点;b点为B的熔点;E点的温度TE比组元A、B低,即E点系统的熔点比两组元低。系统在加热时,E点温度TE也是产生液相的最低温度。组成在E点的系统升温到TE时,A、B同时熔融,故称为低共熔点(eutectic arrest)。E点系统在冷却时,液相在E点消失。
由于组成在E点的系统,其液相降温到TE时,A、B同时从液相中析出,因此在冶金学上常称E为共晶点(eutectic arrest)、GH线为共晶线。低共熔点的说法常见于物理化学和无机非金属材料学科。
4.平衡结晶过程及组织变化
通过对系统平衡结晶过程的分析,我们可了解系统在各平衡态下获得哪些相,以及它们的量。这可为显微结构的分析提供帮助。
1)组成在E′~B间,以N点为例(图8.17)。
(1)平衡结晶过程。将其加热到完全熔融,状态点在液相区的M点。然后,从M点开始冷却。在冷却过程的任何一时刻,系统都处于平衡态。在平衡态下,各组元有充裕的时间和能力进行扩散和传热,以使平衡相的成分达到均匀。
MC段:始终只有液相,F=2。
当温度降到TC时(C点在液相线bE上),B晶相开始析出。这时,系统有液相和B晶相,F=1。在温度和液相组成之间只有一个独立变量。而B晶相不断地从液相中析出,这说明液相必是B的饱和溶液。故液相的成分不能任意改变,而只能在液相线bE上变化。由此可见,能独立变化的只有温度。所以,温度继续降低时,液相沿液相线从C向E移动;B晶相从K向H移动(如图8.17中箭头所示),但系统的组成始终在MN线上。
在TC温度,由于系统始终处于平衡态,故液相和B晶相的温度也相同。这样,CK为一条平行于横坐标的线。同理,温度降低到任一温度时,液相和晶相的温度也相同,它们的连线也是一条平行于横坐标的线,如DJF线。当液相下降到E点时,B晶相点下降到H。
在E点,A晶相开始从液相析出,F=0。由于A的出现,B晶相在固相中的质量分数下降。因此,B晶相从H向R点移动。当液相在E点消失时,B晶相组成达到R点。此时,F=1,温度沿RN下降。以上液相和固相的变化路径可用下式表示:
液相:
![]()
固相:MC段无固相析出,在C点开始有固相析出,而且固相为纯B,所以固相从K点开始:
![]()
当液相消失以后,固相从R点沿RN线降至室温。结果,在室温下,系统由完全不互溶的A、B晶相组成。
(2)平衡凝固的组织变化。N点系统在降温时的组织变化如图8.18所示。
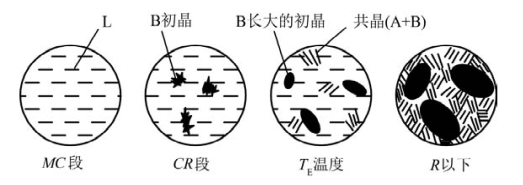
图8.18 N点的系统降温过程中的组织变化示意图(根据郑子樵,2005和傅献彩,1979画出)
系统在C点以上为液态。系统从C点开始析出B。此时析出的B称为B初晶(或初晶B)。在温度降低到TE的过程中(CR段),初晶B逐渐长大。当温度降低到TE时,A、B同时从液体中析出。这种同时析出的B、A具有较特殊的致密结构。B、A总是呈片状或粒状均匀地交错排列在一起构成共晶组织。共晶组织中的B与初晶B的凝固条件不同,因而形态也不同。温度降低到TE以下时,系统为固态。该固态由初晶B与共晶A、B构成。
2)组成在E′点的系统。
(1)平衡结晶过程。(https://www.daowen.com)
液相:
![]()
固相:QE段无固相析出,在E点A、B固相析出。
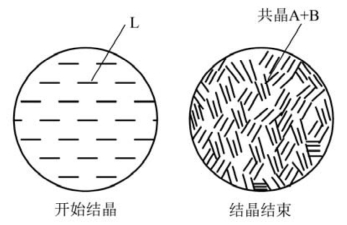
图8.19 E'点系统降温过程中的组织变化示意图
(2)降温过程中的组织变化。在TE温度以上是液相。温度处于TE时,A、B同时结晶而形成共晶组织(图8.19)
3)组成在A~E′间,以V′点为例。
(1)平衡结晶过程。这种系统结晶与组成在E′~B间的系统结晶相似。只不过,首先析出的是初晶A。
液相:
![]()
固相:SP段无固相析出,在P点开始有固相析出,而且固相为纯A。
(2)平衡凝固的组织变化。同样,组织变化与图8.18相似,如图8.20所示。首先析出初晶A。在共晶温度,A、B同时析出而构成共晶组织。
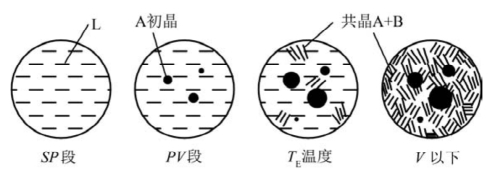
图8.20 V'点系统降温过程中的组织变化示意图(根据郑子樵,2005和傅献彩,1979画出)
需注意的是,图8.18~图8.20中的初晶形貌仅是示意,不代表实际的初晶就一定是这些形状。在实际情形中,初晶的形貌可以是近似球形,还可以是树枝状(枝晶)等。以上介绍的降温结晶过程。在升温过程中发生的变化与上面的情形恰好相反。下面我们利用杠杆规则计算系统在某一温度时,某一相的量。
5.各相量(质量分数、摩尔分数或原子分数)的计算
以N点组成为例。在降温或升温过程中,组分A、B在液相、固相间不断转移,但整个系统的组成始终在MN线上,这一点我们已多次提到。因此,由杠杆规则,“支点”始终是MN线上的点。
1)温度在TD时。由于系统处于平衡态,D、F、J必在一条直线上,温度皆为TD。
液体和固体(此时只有晶态B)的质量之比为
![]()
其中mL为液体质量,mS为固体质量。系统中固体的质量分数为(DJ/DF)×100%(摩尔分数、原子分数的计算与此类似)。
2)温度刚降低到TE时,此时还无A析出。液体和固体的质量之比为
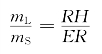
由于此时只有初晶B,因此系统中固体的质量分数也是初晶B的质量分数为(ER/EH)×100%。
温度在TE时,系统中的液相将同时析出A、B,直到液相消失。所以,此时的液相量也是共晶A+B的量。共晶的状态点为E,共晶A+B的质量分数为(RH/EH)×100%。但整个系统中B的质量分数仍为![]()
Bi-Cd二元相图与图8.17相类似。但在更多情况下,图8.17所示的形式往往是许多二元相图的一部分,比如NaCl-H2O的相图(图8.21)。
6.NaCl-H2O的相图
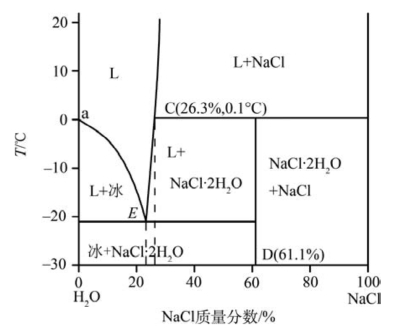
图8.21 NaCl-H2O的相图(低共熔点E处NaCl质量分数为23.3%,温度为-21.1℃)
图8.21中的E为冰和NaCl·2H2O的低共熔点(共晶点)。在-21.1~0℃的冰中加入一定量的NaCl,温度不变时,系统组成进入L+冰区(即部分冰会熔化)。若加入NaCl的量适当,则系统组成会处于液相单相区,而无冰的出现。这也是我们在本章开始时提出的“为什么在结冰的路面上撒盐可使冰融化”的原理。在NaCl-H2O的相图中,组成在D点的系统会形成一种新的化合物NaCl·2H2O。下面我们介绍具有化合物形成的二元系统。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







