以图8.4中晶型Ⅰ升华线AB上的一个状态点为例,图8.5为其局部相图。当晶型Ⅰ沿升华线升温到T3且达到平衡时,晶型Ⅰ在3点要转变为晶型Ⅱ,故T3为多晶转变温度。晶型Ⅱ沿其升华线升温到T2(熔点)。同样在平衡态下,晶型Ⅱ变为熔体。降温时,以上转变过程相反。也就是说,晶型Ⅰ与晶型Ⅱ的转变是可逆的。这种可逆转变可用下式表示:
![]()
图8.6为另一种具有不可逆转变的单元系统。晶型Ⅰ沿升华线升温到T1(熔点),在平衡态下,晶型Ⅰ熔融为液相。而液相降温到T1,在平衡态下,液相转变为晶型Ⅰ。由此可见,晶型Ⅰ与液相的转变是可逆的。

图8.5 具有可逆多晶转变的单元相图(局部)(引自宋晓岚,2006)
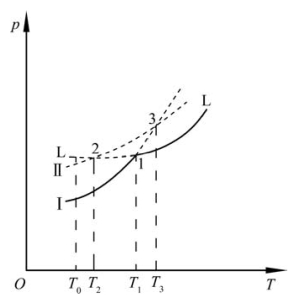
图8.6 具有不可逆多晶转变的单元相图(局部)(引自宋晓岚,2006)
在图8.6的系统中,若熔体L过冷到T1温度以下(1→2的虚线)到达T2温度,此时晶型Ⅱ析出。将晶型Ⅱ升温(2→3的虚线)到达T3温度。T3温度点是晶型Ⅰ与晶型Ⅱ的多晶转变点,也是三相点。但这个三相点实际上得不到。因为此三相点的温度已超过熔点T1,晶体不能过热而超过熔点。即使有过热晶体在熔点以上存在,它也会很快被熔化。那晶型Ⅰ与晶型Ⅱ之间是如何转变的呢?
设图8.6中的晶型Ⅰ,其Gibbs自由能为G1、晶型Ⅱ的Gibbs自由能为G2,则由晶型Ⅱ转变为晶型Ⅰ时的Gibbs自由能差可用下式得出(其他功为零、组成不变):
![]() (https://www.daowen.com)
(https://www.daowen.com)
在一定温度下(如T0),dT=0,故
![]()
积分:

因晶型Ⅰ、晶型Ⅱ皆为固态,故可简化为体积与压强无关(V为常数),故积分后有
![]()
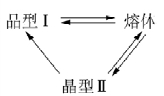
图8.7 晶型Ⅰ、晶型Ⅱ与熔体间的不可逆转变(引自宋晓岚,2006)
因为在T0下,p1<p2,所以ΔG=(G1-G2)<0,故晶型Ⅱ转变为晶型Ⅰ是自发过程。也就是说,晶型Ⅱ处于亚稳态,有向晶型Ⅰ转变的倾向。因此,晶型Ⅰ与晶型Ⅱ的转变是单向不可逆的。这种不可逆转变如图8.7所示。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







