1.扩散系数的推导
以一维扩散系统为例,设x处的化学势为μx。在x处将该化学势展开成Taylor级数,忽略二阶以上的高阶项,得到x+dx处的化学势:
i原子从x处扩散到x+dx处的驱动力Fi为这两处的化学势梯度∂μ/∂x,表示为
i原子从x处扩散到x+dx处的驱动力Fi为这两处的化学势梯度∂μ/∂x,表示为
梯度的方向由低指向高,扩散方向从高化学势指向低化学势,故式(7-71)中引入负符号。i原子在扩散时,假设其平均速率为vi(cm/s)。vi与Fi呈正比关系,引入常数后写成等式:
梯度的方向由低指向高,扩散方向从高化学势指向低化学势,故式(7-71)中引入负符号。i原子在扩散时,假设其平均速率为vi(cm/s)。vi与Fi呈正比关系,引入常数后写成等式:
其中Bi为迁移率,它表示i在单位驱动力作用下的速率。
由于我们是在原子尺度进行讨论,故本节采用物质的量浓度(也就是常说的浓度)。设i原子的浓度为ci(mol/cm3)。该浓度与速率的乘积:
其中Bi为迁移率,它表示i在单位驱动力作用下的速率。
由于我们是在原子尺度进行讨论,故本节采用物质的量浓度(也就是常说的浓度)。设i原子的浓度为ci(mol/cm3)。该浓度与速率的乘积:
式(7-73)的单位恰好是扩散通量的单位[mol/(cm2·s)],故i的扩散通量Ji为
式(7-73)的单位恰好是扩散通量的单位[mol/(cm2·s)],故i的扩散通量Ji为
将式(7-71)和式(7-72)代入式(7-74),得
将式(7-71)和式(7-72)代入式(7-74),得
接下来求式(7-75)中的化学势梯度∂μ/∂x。
接下来求式(7-75)中的化学势梯度∂μ/∂x。
由物理化学知识,i的化学势用浓度表示时可写为![]() +RTlnci,其中
+RTlnci,其中![]() 是i在标态下的化学势,为常数;R为摩尔气体常数;T为热力学温度。对真实溶液体系,常用活度αi代替浓度αi=γici,其中γi为i的活度系数。因此,i的化学势变为
是i在标态下的化学势,为常数;R为摩尔气体常数;T为热力学温度。对真实溶液体系,常用活度αi代替浓度αi=γici,其中γi为i的活度系数。因此,i的化学势变为![]() 。μi对x求导,可得i的化学势梯度:
。μi对x求导,可得i的化学势梯度:
由物理化学知识,i的化学势用浓度表示时可写为![]() +RTlnci,其中
+RTlnci,其中![]() 是i在标态下的化学势,为常数;R为摩尔气体常数;T为热力学温度。对真实溶液体系,常用活度αi代替浓度αi=γici,其中γi为i的活度系数。因此,i的化学势变为
是i在标态下的化学势,为常数;R为摩尔气体常数;T为热力学温度。对真实溶液体系,常用活度αi代替浓度αi=γici,其中γi为i的活度系数。因此,i的化学势变为![]() 。μi对x求导,可得i的化学势梯度:
。μi对x求导,可得i的化学势梯度:
提出∂ci/∂x:
提出∂ci/∂x:
将式(7-77)代入式(7-75):
将式(7-77)代入式(7-75):
整理得
整理得
把上式与Fick第一定律J=-D![]() 进行对比,可以发现式(7-79)就是Fick第一定律。但它是根据化学势推导出来的,因此它比J=-D
进行对比,可以发现式(7-79)就是Fick第一定律。但它是根据化学势推导出来的,因此它比J=-D![]() 更具普遍性。由式(7-79)可知i的扩散系数为
更具普遍性。由式(7-79)可知i的扩散系数为
把上式与Fick第一定律J=-D![]() 进行对比,可以发现式(7-79)就是Fick第一定律。但它是根据化学势推导出来的,因此它比J=-D
进行对比,可以发现式(7-79)就是Fick第一定律。但它是根据化学势推导出来的,因此它比J=-D![]() 更具普遍性。由式(7-79)可知i的扩散系数为
更具普遍性。由式(7-79)可知i的扩散系数为
同理其他原子,如j的扩散系数为
同理其他原子,如j的扩散系数为
其中Di、Dj分别为i原子和j原子在多元扩散系统中的分扩散系数。
对于组元之间无相互作用的理想固溶体或无限稀固溶体,活度系数γi=1或是常数,则式(7-80)变为
其中Di、Dj分别为i原子和j原子在多元扩散系统中的分扩散系数。
对于组元之间无相互作用的理想固溶体或无限稀固溶体,活度系数γi=1或是常数,则式(7-80)变为
式中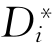 为i的自扩散系数。同理,j的自扩散系数为
为i的自扩散系数。同理,j的自扩散系数为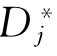 =BjRT。若在微观上考虑的话
=BjRT。若在微观上考虑的话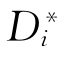 也可写为
也可写为
式中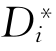 为i的自扩散系数。同理,j的自扩散系数为
为i的自扩散系数。同理,j的自扩散系数为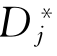 =BjRT。若在微观上考虑的话
=BjRT。若在微观上考虑的话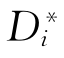 也可写为
也可写为
其中kB为Boltzmann常数。式(7-82)、式(7-83)为能斯特-爱因斯坦方程(Nerst-Einstein equation)。它们表明,在理想固溶体或无限稀固溶体中,不同组元的扩散取决于迁移率的大小。该结论对实际固溶体也适用。式(7-80)和式(7-81)可进一步改写为
其中kB为Boltzmann常数。式(7-82)、式(7-83)为能斯特-爱因斯坦方程(Nerst-Einstein equation)。它们表明,在理想固溶体或无限稀固溶体中,不同组元的扩散取决于迁移率的大小。该结论对实际固溶体也适用。式(7-80)和式(7-81)可进一步改写为
其中![]() +1为热力学因子。式(7-80)、式(7-81)或式(7-84a)、式(7-84b)表示了物质的分扩散系数与自扩散系数和热力学因子有关。(https://www.daowen.com)
+1为热力学因子。式(7-80)、式(7-81)或式(7-84a)、式(7-84b)表示了物质的分扩散系数与自扩散系数和热力学因子有关。(https://www.daowen.com)
下坡扩散时,有
其中![]() +1为热力学因子。式(7-80)、式(7-81)或式(7-84a)、式(7-84b)表示了物质的分扩散系数与自扩散系数和热力学因子有关。
+1为热力学因子。式(7-80)、式(7-81)或式(7-84a)、式(7-84b)表示了物质的分扩散系数与自扩散系数和热力学因子有关。
下坡扩散时,有
此时,扩散系数Di>0,表明物质是从高浓度向低浓度扩散的。
上坡扩散时,有
此时,扩散系数Di>0,表明物质是从高浓度向低浓度扩散的。
上坡扩散时,有
此时,扩散系数Di<0,表明物质是从低浓度向高浓度扩散的。
由于i的摩尔分数Mi可写为Mi=ci/∑ci,且对一定的系统而言∑ci是常数。由此,式(7-84a)、式(7-84b)可分别变为
此时,扩散系数Di<0,表明物质是从低浓度向高浓度扩散的。
由于i的摩尔分数Mi可写为Mi=ci/∑ci,且对一定的系统而言∑ci是常数。由此,式(7-84a)、式(7-84b)可分别变为
在式(7-84a)、式(7-84b)变为式(7-85a)、式(7-85b)的过程中,我们运用了微分理论。因为∑ci是常数,则
在式(7-84a)、式(7-84b)变为式(7-85a)、式(7-85b)的过程中,我们运用了微分理论。因为∑ci是常数,则
其中![]() 也称为热力学因子。
也称为热力学因子。
2.组元热力学因子之间的关系
恒温、恒压下,均相多组分体系中,各组分的化学势之间存在一定的制约关系,即Gibbs-Duhem方程:
其中![]() 也称为热力学因子。
也称为热力学因子。
2.组元热力学因子之间的关系
恒温、恒压下,均相多组分体系中,各组分的化学势之间存在一定的制约关系,即Gibbs-Duhem方程:
若多组分体系含有两种组分,则Gibbs-Duhem方程变为
若多组分体系含有两种组分,则Gibbs-Duhem方程变为
现在我们利用摩尔分数Mi=ci/∑ci来表示化学势。将此Mi表达式代入μi=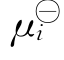 +RTln(γici)中,γi与常数∑ci合并后,仍用γi表示,结果得μi=
+RTln(γici)中,γi与常数∑ci合并后,仍用γi表示,结果得μi=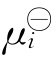 +RTln(γiMi)。再将μi表达式代入两组分的Gibbs-Duhem方程M1dμ1+M2dμ2=0中,整理得
+RTln(γiMi)。再将μi表达式代入两组分的Gibbs-Duhem方程M1dμ1+M2dμ2=0中,整理得
现在我们利用摩尔分数Mi=ci/∑ci来表示化学势。将此Mi表达式代入μi=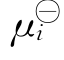 +RTln(γici)中,γi与常数∑ci合并后,仍用γi表示,结果得μi=
+RTln(γici)中,γi与常数∑ci合并后,仍用γi表示,结果得μi=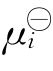 +RTln(γiMi)。再将μi表达式代入两组分的Gibbs-Duhem方程M1dμ1+M2dμ2=0中,整理得
+RTln(γiMi)。再将μi表达式代入两组分的Gibbs-Duhem方程M1dμ1+M2dμ2=0中,整理得
因为M1+M2=1,故dM1=-dM2,则
因为M1+M2=1,故dM1=-dM2,则
两边同时除以dM1:
两边同时除以dM1:
因为dM1=-dM2,所以
因为dM1=-dM2,所以
再整理得
再整理得
写成偏微分的形式:
写成偏微分的形式:
结合式(7-84a)、式(7-84b)、式(7-85a)、式(7-85b)和式(7-85c),我们可知:组元i、j的热力学因子相同;组元扩散系数的不同是因迁移率B不同而引起的;扩散系数与浓度c有关。
结合式(7-84a)、式(7-84b)、式(7-85a)、式(7-85b)和式(7-85c),我们可知:组元i、j的热力学因子相同;组元扩散系数的不同是因迁移率B不同而引起的;扩散系数与浓度c有关。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






