除了在功能材料和金属力学性能方面有重要应用外,点缺陷还对金属的氧化有很大影响。
金属的氧化(特别是高温氧化)是金属材料与周围环境中的气体(如O2)发生的一系列反应过程。通过氧化,金属表面形成一层氧化膜。金属离子与氧离子通过氧化膜的相互扩散控制着金属的进一步氧化,所以金属的氧化涉及正、负离子的扩散。
在金属的氧化过程中,金属氧化物与环境有气体物质交换,故纯金属的氧化是产生本征非化学计量化合物的过程。这些氧化物往往是n型或p型半导体,即它们是电子半导体,而非离子导体。
1.纯金属的氧化机理
在纯金属M与氧接触的瞬间,金属表面迅速生成一层氧化物膜。设该氧化物的化学式为MO。接下来就是离子在膜内的传输。由于正、负离子在膜内的扩散很慢,远低于电子和电子空穴的传输速率,故正、负离子的扩散控制着金属氧化。首先,O2向O2与MO交界面(O2/MO界面)扩散,并以物理吸附的形式吸附在该界面处。随后物理吸附的O2变成原子氧。
氧化膜为p型半导体的氧化物有Fe1-xO、Ni1-xO等。以FeO为例,反应式为式(4-63)。表面的原子氧从周围Fe2+上获得电子呈O2-,并在表面占据FeO中O的正常格点位置。为保持晶体中正、负离子位置数的比例不变,Fe2+的位置数量需要增加。为此,部分Fe2+迁移到表面与O2-结合,原来的Fe2+格点上出现空位V″Fe,所以FeO膜向环境一侧移动而增厚。当Fe2+向表面移动时,V″Fe向FeO/Fe界面处移动。Fe2+及其空位的移动方向相反,如图4.9(a)所示。在FeO/Fe界面的Fe原子失去电子成Fe2+。Fe2+借助于FeO膜内的V″Fe向表面移动。同时,失去的电子也向表面移动,在表面与原子氧结合成O2-。该过程中的主要缺陷反应式为前述式(4-64):
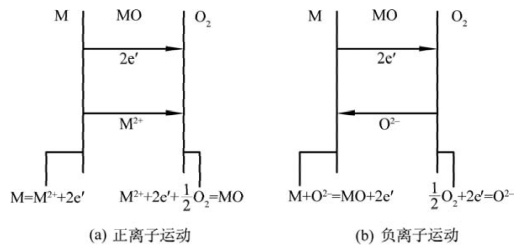
图4.9 金属氧化过程中的相界反应和粒子传输(引自刘培生,2010)
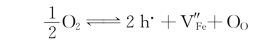
对于氧化膜为n型半导体的氧化物,我们以Zn1+xO为例。在ZnO/Zn界面处,ZnO中的O2-丢掉电子后再与Zn原子结合。原来ZnO膜内的氧减少了,相当于缺氧环境。为保持正、负离子位置数的比例不变,Zn离子进入间隙位,故在氧化膜内留下正、负离子空位。在氧进入金属Zn原子一侧时,氧空位向膜表面即O2/ZnO界面移动,同时O2-丢掉的电子也向O2/ZnO界面移动。在O2/ZnO界面处,原子氧获得移动到表面的电子并借助于氧空位向ZnO/Zn界面处移动,使氧化继续进行,如图4.9(b)所示。可见,ZnO膜的增厚发生在ZnO/Zn界面处。该过程中的主要缺陷反应式,即为式(4-66)或式(4-67):
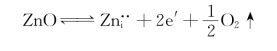
2.合金的氧化
合金高温氧化的影响因素太多而远比纯金属复杂,尚无普适性的理论。在众多理论中,Hauffe-Wagner掺杂原理对此做了一些解释,有一定的参考价值。该原理的假设有:合金生成单相致密氧化膜,金属或氧化剂离子与电子经由氧化物晶格缺陷的扩散反应而使氧化膜生长;氧化膜的生长速率最慢;膜中晶格缺陷的浓度决定膜的生长速率等。
对于n型金属过剩的Zn1+xO膜,缺陷反应见式(4-67)。当在Zn中加入少量Al而形成Zn-Al合金时,氧化膜内有高价Al3+。这就相当于在ZnO中掺杂Al2O3。根据Hauffe-Wagner原理的假设和金属的氧化物大多数是电子半导体,掺杂Al2O3的非化学计量缺陷反应为(www.daowen.com)
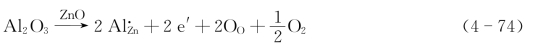
每掺入一个Al3+就放出一个电子,Zn-Al合金体系中的电子浓度增加。根据勒夏特列原理(Le Chatelier's principle),在式(4-67)中,电子浓度增加,反应向左移动,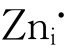 浓度减小,氧化速率降低。这可解释Zn-Al(含质量分数为1%Al)合金在400℃空气中氧化速率的数量级为10-12,该氧化速率比纯金属Zn的氧化速率之数量级(10-10)要小。
浓度减小,氧化速率降低。这可解释Zn-Al(含质量分数为1%Al)合金在400℃空气中氧化速率的数量级为10-12,该氧化速率比纯金属Zn的氧化速率之数量级(10-10)要小。
我们再来看看,在Zn中加入低价金属(如Li)又是何种情形,其缺陷反应为
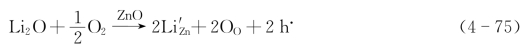
产生的电子空穴与式(4-67)中的电子结合成无缺陷状态:
![]()
nil表示无缺陷。电子空穴与电子的结合使式(4-67)的反应向右移动,Zn的氧化速率增加。实验表明Zn-Li(含质量分数为0.4%Li)氧化速率的数量级为10-7,这比纯金属Zn的氧化速率之数量级(10-10)要大。
而对于p型金属不足的Ni1-xO膜,其缺陷反应与式(4-64)相似。比如,在Ni中加入Cr形成Ni-Cr合金。氧化膜内有高价Cr3+。Cr3+掺入NiO中的缺陷反应:
![]()
Cr的引入使Ni2+空位增加。按照勒夏特列原理,金属离子空位的增加使式(464)向左移动(此例中是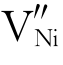 ,而非
,而非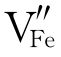 ),氧化速率降低。然而,由于
),氧化速率降低。然而,由于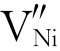 的增加,Ni离子的扩散更容易,这方面的作用更显著,所以Cr的引入造成NiO的氧化速率加快而不是降低。
的增加,Ni离子的扩散更容易,这方面的作用更显著,所以Cr的引入造成NiO的氧化速率加快而不是降低。
在NiO中加入低价金属,如Li,其缺陷反应式为式(4-75)相似而没有离子空位。低价元素的引入使电子空穴的浓度增加。同样,根据勒夏特列原理,式(4-64)向左移动,NiO的氧化速率降低。
综上所述,要降低合金的高温氧化速率,可采用掺杂方式。当氧化膜为金属过剩型的非化学计量化合物时,可掺高价金属(如在Zn中掺Al);而氧化膜为金属不足型非化学计量化合物时,应掺低价金属(如在Ni中掺Li),所以我们可以应用Hauffe-Wagner掺杂原理来设计二元合金,使合金表面形成保护性的氧化膜。
如前所述,影响合金的氧化因素有很多,机理复杂且有待继续探索。而掺杂对合金氧化动力学的影响是有限的,它仅仅是目前众多控制方法之一。工程上最有意义的还是通过选择致密氧化物膜(如Cr2O3、Al2O3、SiO2)来抑制膜下的金属继续发生氧化。
尽管以掺杂形成点缺陷来抑制金属氧化的作用有限,但从点缺陷的形成和传输角度来理解金属的氧化并寻找抗氧化措施,这难道没有为我们提供一种思路来解决金属的氧化吗?以前点缺陷更多的是在无机非金属功能材料上得到应用。现在,把点缺陷的一些理论(如非化学计量化合物)用到金属的氧化上,体现了点缺陷在无机非金属材料基础上的一个拓展。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





